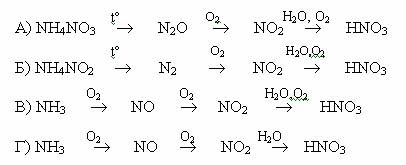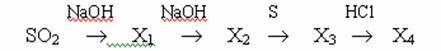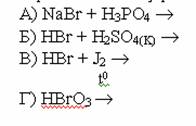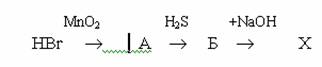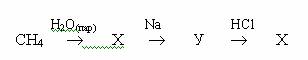Г)14,3 и 5,3г.
10. Реакция, протекающая со взрывом: А)SiO2+HF Б)SiH4+O2 В)SiF4+O2 Г)SiCl4+H2
1.Промышленный способ получения азота это: А) разложение нитрита аммония Б) ректификация жидкого воздуха В) разложение дихромата аммония Г) окисление аммония оксидом меди (II)
2. Электронные конфигурации[Xe]4f145d106s26p3 и [Kr]4d105s25p3 соответствуют атомам элементов: А) Sb и Ku Б) Bi и Sb В) As и P Г) Po и Te
3. Ионное уравнение: HNO2 + OH` ® NO`2 + H2O описывает взаимодействие между: А) CaOHNO3 и HNO2 Б) NaOH и HNO2 В) Ca(OH)2 и HNO2 Г) AgOH и HNO2
4. Аммиак может реагировать с каждым веществом из группы: А) Li; NaOH; O2 Б) Na; H2S; Na2CO3 В) CuO; H2S; O2 Г) CuSO4; NH4Cl; O2
5. Продукты реакции гидролиза трихлорида мышьяка: А) HAsO3; HCl Б) As2O3, HCl В) HAsO2; Cl2 Г) As2O5; HCl 6.Для определения нитрат-ионов в составе вещества используют реакцию с: А) серебром и медью Б) аммиаком В) концентрированной серной кислотой и медью Г) серебром и хлоридом железа
7.Сумма коэффициентов в молекулярном уравнении реакции: ` HNO3(k) + FeS = Fe(NO3)3 + NO2 + S + ….. А) 14 Б) 32 В) 40 Г) 62 8.В результате следующих превращений определите вещество Х; Mg5P2 ® X ® H3PO4 А) P Б) P2O3 В) PCl5 Г) H3PO4
9.Прокаливанием смеси 13,2г нитрита кальция и 13,2г сульфата аммония получают газ объёмом: А)1,12л Б)2,24л В) 3,36л Г) 4,48л
10.Бесцветный ядовитый газ с характерным запахом тухлой рыбы: А) NO2 Б) N2O В) PH3 Г) AsH3
1.Промышленный способ получения азотной кислоты описывает схема превращений:
2.Основность гидридов в ряду NH3 ® PH3 ® AsH3 ® SbH3: А) убывает Б) возрастает В) не изменяется Г) изменяется ступенчато
3.В кратном ионном уравнении CuOHNO3(ТВ) + HNO3 ® …….. сумма коэффициентов равна: А) 4 Б) 5. В) 7 Г) 8
4.Азотная концентрированная кислота может реагировать с каждым веществом из группы: А) HJ; S; SO2 Б) S; C; Al В) Mg; Al; P Г) Сr; Cu; HJ
5.Продукты реакции гидролиза пентанитрида трифосфора: А) P2O5; N2 Б) H3PO4; N2 В) H3PO3; NH3 Г) H3PO4; NH3
6.В три пробирки с концентрированной HNO3 опустили по грануле различных металлов. В первой пробирке выделился бесцветный газ, во второй – бурый, а в третьей реакция не прошла. Это металлы: А) Zn; Cu; Fe Б) Ag; Au; Pt В) Li; Cu; Al Г) Na; K; Al
7.Сумма коэффициентов в молекулярном уравнении реакции: HNO3(K) + S ® А) 12 Б) 16 В) 24 Г) 40 8. В результате следующих превращений определите вещество X. Ca(NO3)2 ® X ® Ca(H2PO4)2 А) CaCO3 Б) H3PO4 В) CaHPO4 Г) CaO
9. Металл массой 60г реагирует с азотом, полученный продукт разлагается горячей водой с выделением газа, который при каталитическом окислении кислородом даёт 11,2л(н.у.) монооксида азота с выходом 50%. Это металл: А) Be Б) Hg В) Ca Г) Ba
10.Бесцветный газ, со сладковатым запахом, не ядовит. Применяется в медицине для наркоза: А) NO Б) N2O В) NH3 Г) PH3
1.Промышленный способ получения аммиака описывает схема превращений:
2.Сила кислот в ряду: HNO3 ® HPO3 ® HAsO3 А) убывает Б) возрастает В) сначала убывает, затем возрастает Г) не изменяется
3.Ионное уравнение 2H2PO`4 + 2H+ ® 2H3PO4 описывает взаимодействие между: А) Ca(H2PO4)2 и H2SO3 Б) Al(H2PO4)3 и HNO3 В) Ca(H2PO4)2 и HNO3 Г) NaH2PO4 и H2S
4.Фосфор может реагировать с каждым веществом из группы: А) H2O; HNO3(K); O2 Б) HNO3(K); NaOH(K); H2SO4(K) В) S; HNO3(K); Na2CO3 Г) CuS; SO2; O2 5.Продукты реакции гидролиза дисульфида тетрафосфора: А) H3PO4; H2S Б) H3PO3; H2S В) H3PO4; H2SО3 Г) PH3; H2SO
6.Соответствуют действительности следующие свойства аммиака: хорошая растворимость в воде тяжелее воздуха взаимодействие со щелочами взаимодействие с кислотами взаимодействие с солями взаимодействие с кислородом восстанавливается кислородом
А) 1,2,4,5 Б) 2,3,4,6 В) все перечисленные свойства Г) 1,4,5,6
7.Сумма коэффициентов в молекулярном уравнении реакции: SbCl3 + NaOH(P) = Sb2O3¯ + H2O ………. А) 12 Б) 18 В) 22 Г) 36
8.В результате следующих превращений определите вещество Х: NH4NO2 ® X ® NO2 А) NH3 Б) N2 В) NO Г) N2O
9.Простое вещество массой 31г образует с магнием 67г соединения состава Mg3N2; при обработке которого избытком соляной кислоты выделяется газ. При его сжигании образуется твердое вещество: А) S Б) P В) N2 Г) Si
10.Бесцветный газ, ядовит с характерным чесночным запахом: А) NO2 Б) PH3 В) AsH3 Г) NH3
1.Промышленный способ получения ортофосфорной кислоты: А) Ca3(PO4)2 + 3H2SO4 = 3CaSO4¯ + 2H3PO4 Б) P2O5 + 3H2O ® 2H3PO4 В) 3P + 5HNO3 + 2H2O ® 3H3PO4 + 5NO
Г) 4H3PO3 ® 4H3PO4 + PH3
2.Тип гибридизации sp- для орбиталей центрального атома отвечает молекуле: А) NH3 Б) PH3 В) NO Г) HNO2
3.В кратном ионном уравнении NaHCO3 + HNO3 ® ……. сумма коэффициентов равна: А) 4 Б) 6 В) 7 Г) 8
4.Ортофосфорная кислота может реагировать с каждым веществом из группы: А) NaCl; Ca; NaOH Б) NaNO3; Mg; NH3 В) NH3; Ca(OH)2; AgNO3 Г)Cu; Ca(OH)2; AgCl
5.Продукты реакции гидролиза дифосфида трикальция: А) Ca(OH)2; H3PO4 Б) Ca(OH)2; PH3 В)Ca(OH)3; P2O5 Г) CaO; H3PO4
6.Соль при 150°С разлагается на три сложных газообразных вещества это: А) (NH4)2Cr2O7 Б) (NH4)2S В) (NH4)2CO3 Г) NH4NO2
7.Сумма коэффициентов в молекулярном уравнении реакции: As + HNO3(K) ® H2O + H3AsO4 + ….. А) 8 Б) 11 В) 13 Г) 15
8.В результате следующих превращений определите вещество X: SbCl3 ® X ® Sb2O А) Sb(OH)3 Б) Sb2O3 В) SbCl5 Г) Sb
9.При нагревании 25,6г соли образуется 14,4г воды и 8,96л(н.у.) химически малоактивного газа, плотность которого по водороду равна 14. Формула соли: А) NH4NO2 Б) (NH4)2Cr2O7 В) NH4NO3 Г)(NH4)2SO3
10.Бесцветная жидкость, яд, с запахом горького миндаля: А) HCN Б) N3H В) N2H4 Г) HPO3
1.Получения мышьяка отражает реакция:
2.Линейную конфигурацию имеет молекула: А) PH3 Б) N2O В) HNO3 Г) HPO2
3.В кратном ионном уравнении (FeOH)NO3(тв) + HNO3 ® ….. сумма коэффициентов равна: А) 4 Б) 5 В) 6 Г) 7
4.Мышьяк может реагировать с каждым веществом из группы: А) H2SO4(K); O2; Cl2 Б) Ca; HCl(P); O2 В) H2O; H3PO4; S Г) H2S; Mg; KOH
5.Продукты реакции гидролиза динитрида тримагния: А) MgO; HNO2 Б) Mg(OH)2; HNO2 В) Mg(OH)2; NH3 Г) MgO; NH3
6.Каким одним веществом различить концентрированные растворы серной, азотной и фосфорной кислот: А) NH3 Б) Ca В) Cu Г) Al
7.Сумма коэффициентов в молекулярном уравнении реакции: Sb + HNO3(K) ® Sb2O5 + ….. А) 14 Б) 18 В) 28 Г) 36
8.В результате следующих превращений определите вещество Х:
А) P Б) HPO2 В) P2O5 Г) Ca3P2
9.Смесь кальция и фосфора нагревают, обрабатывают соляной кислотой; выделившийся газ сжигают в избытке кислорода. Относительная молекулярная масса единственного конечного продукта: А) 56г/моль Б) 98 г/моль В) 109 г/моль Г) 142 г/моль
10.Бинарное соединение, ядовито, на воздухе дымит, подвергается гидролизу с образованием осадка: А) SвCl3 Б) Bi(NO3)3 В) Na3P Г) PH3 1.Простой суперфосфат получают:
2.Тип гибридизации SР2 для орбиталей центрального атома отвечает молекуле: А) NO Б) N2O В) H3PO4 Г) HNO3 3.В кратном ионном уравнении H3PO4 + NaOH(избыток) ® ….. сумма коэффициентов равна: А) 4 Б) 5 В) 7 Г) 8
4.Сурьма может реагировать с каждым веществом из группы: А) H2O; HNO3(K); O2 Б) HCl; HNO3(P); S В) HNO3(K); HNO3(P); Cl2 Г) H2SO4(K); HF; H2O
5.Продукты реакции гидролиза нитрита бария: А) BaOHNO2 HNO2 Б) Ba(OH)2 NH3 В) BaO HNO2 Г) Ba(OH)2 HNO3
6.При добавлении какой соли к раствору Ва(ОН)2 образуется белый нерастворимый в кислотах и щелочах осадок и выделяется газ: А) Nа2SO4 Б) Cu(NO3)2 В) (NH4)2SO4 Г) (NH4)2Cr2O7
7.Сумма коэффициентов в молекулярном уравнении реакции: PH3 + HNO3(K) ® H3PO4 + ….. А) 16 Б) 22 В)32 Г) 36
8.В результате следующих превращений определите вещество Х:
А) NO2 Б) N2O3 В) Cu(NO3)2 Г) N2
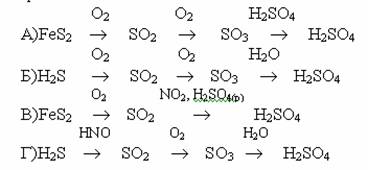
9.Бертолетовая соль вступила в реакцию с фосфором, при этом выделился 71г P2O5. Масса бертолетовой соли: А) 102г Б) 122,5г В) 250г Г) 254,5г 10.Воскообразное вещество, самовоспламеняется, яд хранится в воде: А) черный фосфор Б) белый фосфор В) мышьяк Г) сурьма 1. Схема отражающая химический производственный процесс получения серной кислоты контактным методам:
2. Прочность химической связи в ряду H2O ® H2S ®H2Se ® H2Te: А) возрастает Б) изменяется ступенчато В) ослабевает Г) не изменяется
3. Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции SO2 +H2O +JO3- ® J- + H+ А) 10 Б)13 В)17 Г)21
4. Озон может реагировать с каждым веществом из группы: А) O2, PbS, H2S Б) O2, H2SO4, KNO3 В)K2SO4, CO2, P2O5 Г)P2O5, CO, KMnO4 5. Продукты реакции гидролиза трихлорида серы: А)H2SO4, HCl Б)H2SO3, HCl В)H2S, HCl Г)H2S, HClO 6. Каким одним реактивом можно распознать растворы Na2S и Na2SO3? А)Pb(NO3)2 Б)H2O В)H2SO4 Г)BaCl2
7. Отношение коэффициентов при KMnO4 и H2SO4 в молекулярном уравнении SO2 + H2O + KMnO4 ® H2SO4 + MnSO4 + ….. А)1:1 Б)1:2 В)2:2 Г)2:4 8. Вещества X и Y в схеме превращений FeS2®X®H2SO3 ® Y®Na2S А)H2S, H2S Б)Fe2O3, SO2 В)SO3, H2S Г)SO2, S
9. При взаимодействии 0,4 моль хлорида железа(III) с избытком сульфида натрия образуется осадок массой: А)6,4г. Б)7,02г. В)35,2г. Г)41,6г. 10. Бесцветный газ, с резким запахом, тяжелее воздуха, малорастворим в воде А)H2S Б)SO2 В)SO3 Г)СО
1. Схема отражающая химический производственный процесс получения серной кислоты башенным методом:
2. Восстановительные свойства водородных соединений серы, селена, теллура с увеличением атомной массы элемента: А) изменяются ступенчато Б) не изменяются В) ослабевают Г) возрастают
3. Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: SO2 + H2O +MnO4- ® H+ +Mn2+ А)6 Б)8 В)14 Г)20 4. Сера может реагировать с каждым веществом из группы: A)SO2, H2S, O2 Б)Na2S2O3, HNO3(k), H2SO4(k) В)NaOH, Na2SO3, H2O Г) NaOH, C, H2SO4(k) 5. Степень гидролиза сульфата меди(II) увеличится: А) при уменьшении теипературы Б) при добавлении в раствор NaOH В)при добавлении в раствор H2SO4 Г) при увеличении концентрации CuSO4 6.Соль окрашивает пламя в фиолетовый цвет и с раствором нитрата свинца(II) образует черный осадок: А)Na2S Б)K2S В)K2SO3 Г)Cu2S
7.Отношение коэффициентов при H2SO4 и H2S в молекулярном уравнении: H2SO4 +KJ ®H2S +K2SO4 + … А)1:2 Б)2:3 В)3:2 Г)5:1
8. Конечный продукт X4 в схеме превращений:
А)Na2SO3 Б)H2SO4 В)S Г)H2S 9.Объемная доля(%) сероводорода в 5л технического газа(примеси инертны), затраченного на реакцию с 0,05 моль дихромата калия в кислой среде: А)52% Б)67% В)72% Г)84% 10. Термически не устойчивый, ядовитый оксид использующийся для обезвоживания азотной кислоты: А)SO2 Б)SeO2 В)TeO Г)SO3 1. Диоксид серы можно получить: 1) обжигом пирита; 2)взаимодействием сероводорода с концентрированной азотной кислотой; 3)сплавлением серы со щелочью; 4)взаимодействием H2S с концентрированной H2SO4; 5) взаимодействием фосфора с концентрированной H2SO4. Какие из перечисленных схем соответствуют действительности. А) 1,2,3,4 Б)1,4,5 В)1,3,4,5 Г)1,3,4
2.В молекуле сероводорода химическая связь: А)ионная Б)ковалентная неполярная В) водородная Г) ковалентная полярная 3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: H+ +SO42- + H2S ® S + SO2 + …. А)6 Б)8 В)10 Г)16 4. Сероводород может реагировать с каждым веществом из группы: А)H2SO4(K), SO2, CO Б)AgNO3, KMnO4, SO2 В)KMnO4, NaCl, S Г)H2O, S, NaOH 5.Кислота и основание образуются при сливании растворов: А)Na2S и BaCl2 Б)СuSO4 и Ba(NO3)2 В)Na2S и NH4Cl Г)Na2SO3 и K2SO4
6. Как можно различать порошки сульфита натрия и гидросульфита натрия? А)добавить воды Б)добавить кислоты В)добавить щелочи Г)прокалить 7. Отношение коэффициентов при Na2SO3 и Na2SO4 в молекулярном уравнеинии Na2SO3 + H2O+ KMnO4 ® Na2SO4 +….. А)1:1 Б)2:2 В)3:3 Г)4:4
8.Вещества X и Y в схеме превращений: H2S ® X ® NaHSO3 ® y ® BaSO4 А)S, BaHSO3 Б)SO2, BaSO3 В)SO2, BaHSO3 Г)S,Na2SO4
9.Газ – продукт полного сгорания 10,08 л (н.у.) сероводорода в кислороде – поглощают с помощью 200 г 20% раствора щелочи и получают соль количеством: А) 0,25 моль Б) 0,45 моль В) 0,9 моль Г) 1 моль 10. Гигроскопичная оксо кислота растворяющая золото: А)H2SO4 Б) HNO3 В)H2SeO4 Г)H2SeO3
1.Кислород можно получит при действии:
Какие из перечисленных схем отражают действительность? А) 1,3,5,7 Б)1,3,5,6,7 В)1,2,3,7 Г)1,2,3,4,5,6 2. Тип гибридизации sp2 для орбиталей центрального атома отвечает молекуле: А)H2O Б)SO2 В)SO3 Г)Na2SO4 3. Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: SeO32-+Cl2 + OH- ®SeO42- +2Cl- + ….. А) 5 Б)6 В)8 Г)12 4. Кислород может реагировать с каждым веществом из группы: А)H2O, S, Al Б)NaOH, CO, Na2O2 В)Na2O2, NH3, SO2 Г)NH3, F2, NaO2 5. Продуктами гидролиза тетрахлорида селена являются: А)H2SeO3 и HCl Б)H2SeO3 и HClO В)H2SeO4 и HCl Г) SeO2 и HCl
6. Как распознать порошки MgSO4 и Na2SO4: А) прокалить Б) добавить воды В)добавить раствор BaCl2 Г) добавить раствор щелочи
7. Отношение коэффициентов при H2O2 и O2 в молекулярном уравнении H2O2 + H2SO4 + KMnO4 ® MnSO4 + O2 +…… А)1:1 Б)2:2 В)3:4 Г)5:5
8. Вещества X и Y в схеме превращений: H2SO4 ® X ®Y® H2SO4 А)H2S, S Б)H2SO3, S В)H2S, BaCl2 Г)SO2, H2S 9.Пирит массой 200кг., содержащий 10% примесей, обработали 70% раствором серной кислоты массой 336кг. Выход серной кислоты составляет: А)90% Б)88% В)80% Г)76% 10. Светло-синий газ с характерным запахом, разлагается под действием ультрафиолетовых лучей: А)O2 Б)O3 В)H2O2 Г)H2Se
1.Сероводород можно получить при действии: 1) FeS2 + HNO3 ® 2) Cu + HNO3(K) ® 3) FeS + H2SO4 ® 4) BaS + H2O + CO2 ® 5) S + HJ ® 6)S + NaOH ® 7) S + H2SO4(K) ® Какие из перечисленных схем отражают действительность? А) 3,4,5 Б)1,2,4,7 В)3,4,5 Г)2,3,6,7 2.Какие утверждения соответствуют действительности: 1)число протонов в атоме серы всегда – 32 2)число нейтронов в атоме серы –32 3)число протонов в атоме серы всегда –16 4)число нейтронов в атоме серы всегда 16
А)3,4 Б)1 В)3 Г)1,2
3. Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции H+ + SeO32- + J- ® Se + J2 + H2O А)10 Б)13 В)17 Г)22 4. Концентрированная серная кислота может реагировать с каждым веществом из группы: А) Ag, H2S, S Б) Be, Fe, KJ В) HCl, Cu, NH3 Г)NaOH, NO, N2O5 5. Продуктами гидролиза тетрахлорида теллура являются: А)H2TeO3, HCl Б)H2TeO4, HCl В)TeO2, HCl Г)TeO3, HCl 6. Соль окрашивает пламя в кирпично-красный цвет и при ее разложении выделяется газ, обесцвечивающий раствор KMnO4. Это соль: А)MgSO3 Б)CaS В)CaSO4 Г)BaSO4
7.Отношение коэффициентов при О3 и О2 в молекулярном уравнении O3 + H2O + KJ ® J2 + O2 + … А)1:1 Б)1:2 В)2:2 Г)2:4
8. Вещества X и Y в схеме превращений
А)SO2, H2SO4 Б)H2SO4, H2SO4 В)S, H2S Г)H2SO4, H2SO3
9.При пропускании 10л. сероводорода (н.у.) через раствор сернистой кислоты массой 1кг. Образовалось 19,2 г. серы. Массовая доля сернистой кислоты в растворе: А)0,82% Б)1,5% В)6,8% Г)8,2% 10. Бесцветный газ, малорастворим в воде, без запаха, в жидком состоянии имеет цвет: А)О3 Б)SeO3 В)O2 Г)SO2 1. Серу можно получить при действии: 1)H2S +SO2® 2)H2S + HNO3(K)® 3)H2S + Br ® 4)FeSO3® 5)извлечение из самородной руды с помощью горячей H2O 6)обработкой самородных руд H2SO4 7)H2S + O3®
Какие из перечисленных схем отражают действительность? А)2,3,5 Б)1,3,5 В)1,3,7 Г)2,4,5,6 2. Неметаллические свойства в ряду Te-Se-S: А)возрастают Б)убывают В)изменяются ступенчато Г)не изменяются 3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции H2S + MnO4- ®MnO2 + S + H2O +OH- А)6 Б)8 В)12 Г)14 4.Диоксид серы может реагировать с каждым веществом из групп: А)H2O, H2S, HCl Б)SO3, Na2S, O2 В)Na2SO4, H2S, O2 Г)NaOH, HNO3(K), Na2CO3 5.Концентрация гидроксид ионов в растворе сульфита натрия ументшится при добавлении: А)воды Б)раствора нитрата серебра В)хлорида бария Г)сульфата натрия 6.Каким одним реактивом различить растворы серной, азотной и сероводородной кислот? А)Cu Б)BaCl2 В)PbCl2 Г)S
7.Отношение коэффициентов при Se и SeO2 в молекулярном уравнении Se + H2SO4(K) ® SeO2 + …. А)1:1 Б)1:2 В)2:2 Г)2:3
8. Вещества X и Y в схеме превращений: KClO3 ® X®Y®PbSO4 А)KCl, AgNO3 Б)KCl, PbCl В)O2, SO2 Г)KClO4, H2SO4
9.Газ полученный при обжиге 0,5г. смеси сульфидов меди и цинка, содержащих 3,3% негорючих примесей, обесцветил 100 мл. 0,1н раствора йода. Процентное содержание сульфидов меди и цинка в смеси: А)9,5% CuS и 90,5% ZnS Б)19,2% CuS и 77,6% ZnS В)38,4% CuS и 61,6% ZnS Г)50% CuS и 50% ZnS 10. Ядовитый, бесцветный газ с резким запахом, хорощо растворим в воде: А)O3 Б)О2 В)SO2 Г)H2S 1.Основной способ получения фтора: А)электролиз расплава KHF2 Б)электролиз раствора KHF2 В)электролиз раствора HF Г)CaF2 + H2SO4(конц) ®
2.Галогены в реакциях могут проявлять: А) только окислительные свойства Б) только восстановительные свойства Г) окислительные и восстановительные свойства Д) галогены не проявляют окислительно-восстановительных свойств
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: ClO2 + CO32- ® ClO2- + ClO3- + CO2 А) 5 Б) 6 В) 9 Г) 11
4.Хлор может реагировать с каждым веществом из группы: А) H2O; NaOH; SiO2 Б) H2O; O2; HJ В) NaOH; F2; Ca(OH)2 Г) P; Fe; MnO2
5.Продукт гидролиза ZnCl2, реагирующий с цинком: А) ZnOHCl Б) Cl2 В) HCl Г) Cl2O
6.Соляную кислоту можно отличить от других кислот по реакции с: А) диоксидом марганца Б) серебром В) ионами серебра Г) карбонат-ионами
7.Сумма коэффициентов в молекулярном окислительно-восстановительном уравнении: ClO2 + KOH ® А) 5; Б) 7 В) 10 Г) 12
8.Вещества Х и У, образующиеся в результате превращений: NaJ ® X ® Cl2 ® У ® O2 А) J2; KClO3 Б) NaCl; KClO3 В) HCl; NaClO Г) NaOH; HCl
9. 100 мл газовой смеси, состоящей из водорода и хлора пропустили через раствор иодида калия. Объём непоглащённого остатка составил 53 мл. Объёмный состав смеси: А) 40% Cl2; 60% H2 Б) 47% Cl2; 53% H2 В) 53% Cl2; 47% Н2 Г)60% Cl2; 40% Н2
10. Газ жёлто-зелёного цвета, с резким запахом тяжелее воздуха, ядовит, негорюч: А) HCl Б) ClO2 В) Cl2 Г) F2
1.Определите схему реакции, в результате которой можно получить хлор: А) K2Cr2O7 + HCl ® Б) PbO + HCl ® В) FeO + HCl ® Г) PCl5 + H2O ®
2.В соединениях хлор проявляет степени окисления: А) –1; +3; +5; +7 Б) -1; +1; +3; +4; +5; +7 В) –1; +1; +3; +5; +7 Г) -1; -3; +1; +3; +5; +7
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: H+ + Cl- + ClO3- ® Cl2 + 3H2O А) 6 Б) 12 В) 18 Г) 32
4.Хлороводород может реагировать с каждым веществом из группы: А) CaCO3; J2; NH3 Б) NH3; KMnO4; AgNO3 В) AgNO3; K2Cr2O7; H2SO4(K) Г) Ca(NO3)2; H2S; NaOH
5.При гидролизе гипохлорита натрия образуются: А) NaOH и Cl2 Б) NaCl и HClO В) NaOH и HClO2 Г) NaOH и HClO
6.Соль окрашивает пламя в жёлтый цвет и с раствором нитрата серебра образует жёлтый осадок: А) BaCl2 Б) CaJ2 В) NaBr Г) KJ
7.Сумма коэффициентов в молекулярном окислительно-восстановительном уравнении: KClO3 + H2C2O4 + H2SO4 ® ClO2 + …. А) 5 Б) 9 В) 11 Г) 15 8.Вещества Х,У образующиеся в результате превращений: KMnO4 ® Х2 ® KClO3 ® HClO4 А) Cl2; KClO4 Б) Cl2; ClO2 В) KCl; KClO4 Г) HCl; KClO
9.Газ, полученный при действии серной кислоты на 58,5г поваренной соли, растворили в 146г воды. Массовая доля вещества в полученном растворе: А) 10% Б) 14% В) 20% Г) 31%
10.Бесцветный газ с резким запахом, тяжелее воздуха, хорошо растворим в воде: А) F2 Б) Cl2 В) ClO2 Г) HCl
1.Определите схему реакции, в результате которой можно получить бром:
2.Потенциальная ионизация в ряду Cl ® Br ® J: А) убывает Б) возрастает В) не изменяется Г) изменяется ступенчато
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: Cl2 + H2O2 ® H+ + Cl- + O2 + …… А) 5 Б) 11 В) 13 Г) 18
4.Бром может реагировать с каждым веществом из группы: А) F2; NaOH; AgNO3 Б) HCl; H2O; NaOH В) NaCl; H2O; H2S Г) NaJ; H2; O2
5.При гидролизе монофторида хлора образуются: А) HF и HClO Б) HF и HCl В) F2 и HClO Г) HF и HClO3
6.Две соли различных кислот окрашивают пламя в фиолетовый цвет и при разложении этих солей выделяется бесцветный газ. Это: А) LiNO3 и LiNO2 Б) Na2CO3 и NaNO3 В) KClO3 и KBrO4 Г) K2SO3 и KNO3
7.Сумма коэффициентов в молекулярном окислительно-восстановительном уравнении: HBr + H2SO4(K) ® Br2 + ……… А) 7 Б) 9 В) 11 Г) 13
8.Вещество Х, образующееся в результате превращений:
А) H2S Б) S В) J2 Г) HJO3
9.Практический выход газа, образовавшегося при взаимодействии 0,18 моль пернанганата калия с соляной кислотой составил 78%. Объём полученного газа: А) 4л Б) 8л В) 12л Г) 22л
10.Газ светло-жёлтого цвета, ядовит, легче воздуха, хорошо растворим в воде, сильнейший окислитель: А) HF Б) F2 В) Cl2 Г) HCl 1.Промышленный способ получения хлороводорода:
2.В соединениях фтор проявляет степени окисления: А) –1 Б) –1; +1 В) –1; +1; +3 Г) -1; +1; -3; +3; +5; +7
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: BrO3- + H+ + Br- ® Br2 + H2O А) 6 Б) 7 В) 9 Г) 11
4.Иод может реагировать с каждым веществом из группы: А) H2S; H2O; CuO Б) H2; Na; KCl В) Al; SO2 × H2O; H2 Г) H2S; Na; CaCO3
5.При гидролизе нитрида трихлора образуются: А) HNO3 и HCl Б) NH3 и HClO В) NH3 и HCl Г) HNO2 и HClO
6.Каким одним реактивом можно распознать соли CaCl2, BaJ2, KBr? А) NaOH Б) HNO3 В) H2S Г) AgNO3
7.Сумма коэффициентов в молекулярном окислительно-восстановительном уравнении: J2 + HNO3(P) = HJO3 + ….. А) 7 Б) 11 В) 21 Г) 31
8.Определите вещество Х, образующееся в результате превращений:
А) NaBrO Б) NaBrO3 В) NaBr Г) Na2S
9.При термическом разложении на катализаторе 49г хлората калия образуется газ, полностью затраченный на сжигание серы. Получено 11.76л (н.у.) продукта. Выход газ в первой реакции: А) 10,5% Б) 32,5% В) 62,5% Г) 87,5%
10.Оксид хлора – бесцветная, маслянистая жидкость, растворима в воде, очень взрывоопасна: А) Cl2O Б) ClO2 В) Cl2O6 Г) Cl2O7
1.Лабораторный способ получения водорода: А) Zn + H2SO4 ® ZnSO4 + H2 Б) Zn + 2HCl ® ZnCl2 + H2 t0 В) CH4 + H2O ® CO + 3H2 Г) 2NaCl + 2H2O = H2 + Cl2 + 2NaOH
2.Восстановительные свойства наиболее ярко выражены у: А) Br Б) Cl В) J Г) F
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: J2 + ClO- + OH- ® Cl- + JO3- + …. А) 7 Б) 13 В) 16 Г) 22
4.Фтор может реагировать с каждым веществом из группы: А) H2O; Cl2; NaOH Б) SiO2; H2O; HNO3 В) H2SO4; CuO; H2 Г) KMnO4; Na; FeO
5.При гидролизе пентафторида йода образуются: А) HF и HJO Б) HF и HJO3 В) F2 и HJO3 Г) HF и HJO4
6.Как обнаружить примесь хлороводорода в кислороде: А) пропустить газы через раствор серной кислоты Б) пропустить газы через воду В) пропустить газы через раствор AgNO3 Г) пропустить газы через раствор Cu(NO3)2
7.Отношение коэффициентов исходных реагентов реакции J2 + NaOH ® NaJO3 + …. А) 1: 2 Б) 2: 3 В) 4: 5 Г) 1: 4
8.Определите вещества Х и У, образующиеся в результате превращений: Р ® Х ® НВr ® У ® NaBrO А) H3PO4; NaBr Б) Br; NaBr В) PBr3; NaBr Г) PBr5; NaBrO3
9.По реакции 83,3г твёрдого бромида калия с избытком концентрированной серной кислоты получают простое вещество с плотностью 3,12г/мл и объёмом (мл): А) 18л Б) 22,4л В) 36л Г) 45л
10.Формула хлорной извести: А) CaCl2 Б) KClO3 В) Ca(ClO)2 Г) Ca(ClO4)2
1.Определите схему реакции, в результате которой можно получить хлорную известь: А) Ca(OH)2 + HCl ® Б) Ca(OH)2 + HCLO3 ® В) Ca(OH)2 + Cl2 ® Г) CaO + ClO2 ®
2.Сила кислот в ряду HClO ® HClO2 ® HClO3 ® HClO4 А) возрастает Б) убывает В) не изменяется Г) изменяется ступенчато
3.Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: BrO3- + F2 + OH- = BrO4- + F- + …. А) 8 Б) 10 В) 16 Г) 18
4.Фтороводород может реагировать с каждым веществом из группы: А) SiO2; CaSO4; Na Б) SiO2; NaOH; Na2O2 В) Si; H2SO4; NaOH Г) Na2O2; Si; SO2
5.При гидролизе монохлорида брома образуются: А) HCl и HBrO2 Б) Cl2 и Br2 В) HCl и HBrO Г) HClO и HBrO
6.Каким одним реактивом распознать соли PbCl2 CuCl2 и NH4Cl А) H2O Б) NaOH В) CaCO3 Г) H2SO4 7.Отношение коэффициентов исходных реагентов реакции: HJ + H2SO4(K) ® H2S + …. А) 1: 4 Б) 5: 7 В) 2: 9 Г) 8: 1
8.Определите вещества Х и У, образующиеся в результате превращений:
А) CO; Na4C Б) CO2; Na2CO3 В) CO; NaH Г) H2; NaH
9.При добавлении избытка соляной кислоты к раствору гипохлорита кальция массой 5,34г выделилось 0,3л газа(н.у.). Массовая доля гипохлорита кальция в исходном растворе: А) 16% Б) 18% В) 32% Г) 46%
10.Фиолетово-чёрные кристалы, плохо растворимы в воде, хорошо растворим в органических растворителях. Спиртовый раствор этого вещества широко используется в медицине: А) HBr Б) Br2 В) J2 Г) KJ 1.Чистый хром получают: А) восстановлением углем хромистого железняка Б) алюмотермией Cr2O3 В) восстановлением водородом Cr2O3 Г) электролизом расплава Сr2O3 2.Марганец в соединениях проявляет степени окисления: А) +1, +2, +4, +6 Б) +2,+4, +6, +7,-1 В) +1, +3, +5, +7 Г) +2, +3, +4, +5, +6, +7 3. Сумма коэффициентов в ионном уравнении окислительно-восстановительной реакции: SO32- + OH- + MnO4- ® SO42- + Mn42- + … А)7 Б)9 В)11 Г)15 4. Медь при определенных условиях может реагировать с каждым веществом из группы: А)H2SO4(p), O2, HNO3(K) Б) CuO, NO2, H2SO4(K) В)H2O, S, HNO3(P) Г)HCl, HNO3(K), Cl2 5. При сливании водных растворов Fe(NO3)3 и Na2S образуются малорастворимые вещества: А)Fe2S3, H2S Б)Fe(OH)3, H2S В)Fe2O3, Fe(OH)3 Г)Fe2O3, Fe2S3 6.Каким одним реактивом можно различить растворы AgNO3, Cr(NO3)3, NH4NO3 А)H2O Б)H2SO4 В)H2S Г)NaOH 7. Сумма коэффициентов в молекулярном уравнении реакции KMnO4 + H2S(p) ® равна: А)13 Б)14 В)16 Г)20
8.Вещество X1 в схеме превращений
А)K[Cr(OH)4] Б)Сr2O3 В)Cr Г)K2CrO4 9. При взаимодействии раствора щелочи с раствором хлорида железа (II) образовалось 36г. осадка, масса которого при стоянии на воздухе увеличилась. Масса осадка увеличилась на: А)2,8г. Б)3,2г. В)6,4г. Г)8,4г. 10. Если цинк находится в контакте с кадмием в нейтральной среде, то продуктами коррозии являются. A)Zn(OH)2; H2 Б)Сd(OH)2 В)Zn(OH)2 Г)CdO, H2O
1.Промышленный способ получения марганца: А) восстановлением углеродом MnO2 Б) электролизом раствора KMnO4 В) восстановлением водородом KMnO4 Г) восстановлением кремнием Mn2O7 2. Окислительные свойства катионов в водном растворе в ряду Fe2+ - Cu2+ - Ag+: А)убывают Б)возрастают В)не изменяются Г)изменяются ступенчато 3. Сумма коэффициентов в кратном ионном уравнении реакции AgNO3 + KOH = А) 3 Б) 5 В) 6 Г) 8 4.Оксид цинка при определенных условиях может реагировать с каждым веществом из группы: А) NH3·H2O(конц.), HCl, H2O Б) NaOH, H2O, H2 В) NaOH, NH3·H2O(конц.), SiO2 Г) NaOH, H2SO4, H2O 5.Медный лом прокаливают на воздухе и получившийся продукт обрабатывают 70%-ным раствором серной кислоты. При этом образуется: А)CuSO4
|