Расчет обменного кальция.
Записывают нормальность пт и количество (в мл) трилона Б VT, затраченного на титрование фильтрата. Содержание Са2+ вычисляют по одной из формул: VT* nT*1000 Хса=-------------------, мг-экв/л Vф
VT* nT *1000* Eca Хса=---------------------------, мг/л Vф
VT* nT * 100* 0,020 %са=-----------------------------, % Vф
VT* nT* 100 Хса=------------------, мг-экв/100г глины Р(1 – К)
где Уф - объем исследуемого фильтрата, мл; Еса - эквивалентный вес кальция, равный 20; Р - навеска глины, г; К - влажность глины.
В. Определение содержания ионов натрия в обменном комплексе глин
Реактивы: 0,5 Н раствор углекислого аммония, 0,01 Н раствор соляной кислоты, 0,01 Н раствор едкого натра, фенолфталеин. 1. 5 г воздушно-сухой глины обработать в фарфоровой чашке 50 мл раствора углекислого аммония. 2. Смесь перенести на воронку с бумажным фильтром и обрабатывают четырьмя порциями углекислого аммония. 3. Выпарить фильтрат. 4. Растворить в 20 мл раствора соляной кислоты и добавить фенолфталеин. 5. Избыток кислоты оттитровать в фарфоровой чашке раствором едкого натра до появления розовой окраски фенолфталеина.
Содержание ионов Na+ и К+ определяется по формуле:
an1 – bn2 NNa+= ---------------- * 100 мг-экв/100г глины P(1 - K) где а - количество раствора соляной кислоты, мл; n1 - нормальность раствора НС1; в - количество раствора едкого натра, мл; n2 - нормальность раствора NaOH.
ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты занести в таблицу. Сделать вывод о типе глины. Таблица 4.
Контрольные вопросы
1. Особенности строения глинистых минералов. 2. Что такое обменный комплекс глин и емкость поглощения? 3. Покажите, какие реакции имеют место при проведении опытов? Какой тип глины при этом получается? 4. Какие реакции имеют место на поверхности глин при обработке раствора СаСl2, КСl? 5. Как влияет емкость поглощения на свойства глинистых суспензий? 6. Существует ли взаимосвязь между составом обменного комплекса и сохранения устойчивости стенок скважины? Если да, то какая?
ЛАБОРАТОРНАЯ РАБОТА N 3
ОПРЕДЕЛЕНИЕ СОСТАВА ВОДОРАСТВОРИМЫХ СОЛЕЙ В ФИЛЬТРАТЕ БУРОВОГО РАСТВОРА
Одним из важнейших этапов исследования буровых растворов является анализ фильтратов, в частности, степень минерализации и состав водорастворимых солей. Это связано с тем, что качество буровых провымочных жидкостей оцениваемое чаще всего реологическими св-ми. Процентное содержание Снсоз. = [НСО3]*0,061 3. Пробу- не выливать. 4. Полученные результаты внести в таблицу 1.
III. Определение хлоридов (аргентометрический метод)
Определение хлоридов основано на образовании труднорастворимого осадка хлорида серебра при титровании нитратом серебра в присутствии хромата калия по уравнениям:
Из раствора сначала выделяется белый осадок хлорида серебра. Раствор сохраняет в течение этого времени желтую окраску от присутствия в нем ионов СгО42-. После связывания всех ионов хлора образуется красно-бурый осадок хромата серебра.
Порядок работы:
1, В пробу фильтрата после определения карбонатов и бикарбонатов налить 1 мл хромата калия. 2. Смесь титровать раствором нитрата серебра до образования суспензии красно-бурого цвета.
Содержание хлоридов: VAgNO3 * n2 * 100 [Cl-] = -------------------------- [ мг-экв/л] V где VAgno3- объем нитрата серебра, затраченный на титрование; n2 - нормальность нитрата серебра.
В процентах: Ccl = [С1]*0,035
IV. Определение ионов кальция
Метод основан на комплексонометрическом титровании кальций-иона в присутствии индикатора - мурексида. Уравнение реакции и условия титрования можно выразить следующим образом: Са+ Ind+ H2I2- = CaI2- + 2H+ +Ind (розовая)(бесцв.) (бесцветная) (фиолетовая)
Трилон Б, используемый при титровании, извлекает ион кальция из растворимого окрашенного комплекса с мурсксидом. При этом розовая окраска изменяется в фиолетовую. Реакция протекает в щелочной среде, поэтому к фильтрату добавляют сильно-щелочной буферный раствор (10%-ный раствор NaOH или КОН).
Порядок работы:
1. 2-3 мл фильтрата разбавить до 100 мл дистиллированной водой. 2. Обработать пробу NaOH или КОН (5-10 мл, чтобы рН был выше 12). 3. Добавить мурексид до появления розовой окраски. 4. Титровать трилоном Б до изменения окраски в фиолетовую (лиловую, сиреневую). В правильности определения можно убедиться прибавлением двух капель трилона Б. Окраска не должна меняться. Содержание ионов кальция: VT’ * nT * 100 [Ca2+ ] = ---------------------, [мг-экв/л], V где Vt - объем трилона Б, затраченный на титрование; nт - нормальность трилона Б В процентах: Сса2+ = [Са2+]*0,020 V. Определение ионов магния
Метод основан на определении суммарного содержания ионов кальция и магния с помощью комплексонометрического титрования трилоном Б в присутствии индикатора - хромогена черного (эриохром верный Т). Вычитая из смеси содержание кальция, по разности узнают содержание ионов магния. Уравнение реакции можно выразить следующим образом:
Mglnd + Н2I2- = Mgl2- + 2Н+ + Ind (винно-красная)(бесцветн.)(бесцветная) (сине-голубая)
Порядок работы: 1. Взять 2 мл фильтрата и разбавить до 100 мл дистиллированной водой. 2. Добавить 5-7 мл аммиачного буферного раствора, обеспечивающего рН =10. 3. На кончике шпателя внести индикатор - хромоген черный, чтобы окраска стала винно-красной. 4. Медленно титровать при энергичном перемешивании трилоном Б до перехода окраски через лиловую в сине-голубую. Содержание ионов магния: (V'т-V’’T) * nT*100 [Mg2+] =--------------------- ---- [мг-экв./л], V
где V’ T,V"T - объем трилона Б, затраченный на титрование соответственно (Са2+ + Mg2+) и Са2+; nт - нормальность трилона Б. В процентах; Смg2+ = [Mg2+]*0,012
VI. Определение сульфатов (комплексонометрический метод) Сульфат-ионы можно определить двумя способами: - весовым, когда сульфат осаждают хлоридом бария. Осадок фильтруют, промывают, прокаливают и взвешивают; -комплексонометрическим, при котором сульфат-ионы осаждают хлоридом бария, избыток ионов бария оттитровывают трилоном Б по хромогену черному.
Порядок работы:
1. Провести качественную пробу: в фильтрат добавить ВаСЬ. Если выпадет осадок, провести титрование. 2.2-3 мл фильтрата разбавить до 100 мл дистиллированной водой, х^. 3. Подкислить пробу соляной кислотой до рН~3 (по индикаторной бумаге), 4. Обработать раствор хлоридом бария в объеме 10-20 мл в зависимости от интенсивности осадкообразования (по результатам качественного анализа). 5. Колбу с пробой поставить кипятить. 6. После 15-ти минутного кипячения и последующего охлаждения нейтрализовать кислоту 10%-ным раствором NH4OH до рН=5. 7. Добавить аммиачный буферный раствор (до рН= 10). 8. Внести в пробу хромоген черный и титровать трилоном Б до перехода окраски в синий (фиолетовый) цвет. При этом оггитровьгоается сумма катионов (Ва2+ + С а24" + Mg2+). Содержание сульфат-ионов: [ Vб* n – (V’’T – V’T) * nT] *100 [SO42-] = ----------------------------------------- [ мг-экв/л] V где Vб - объем раствора хлорида бария, мл; V’’T,VT’ - объем трилона Б на. титрование соответственно (Ва2+ + Са2+ + Mg2+) и (Са2+ + Mg2+); n - нормальность хлорида бария. В процентах: Сso42- = [SO42-]*0,048 VII. Определение ионов натрия Определение ионов натрия производят по разности: [Na+ + K+] = [CO32-] + [HCO3-] + [Cl-] + [SO42-] – [ Ca2+ + Mg2+], [мг-эхв./л], В процентах в пересчете на натрий: CNa = [Na+ + К+]*0,023 Все данные представить в виде таблицы. Таблица 5. Степень минерализации и состав фильтрата.
Контрольные вопросы
1. Какую роль в бурении играет состав и количество водорастворимых солей в фильтрате бурового раствора? 2. В каких случаях изменяется солевой состав фильтрата? 3. В каких промывочных жидкостях требуется постоянный кончив за составом фильтрата? 4. Объясните сущность методов определения главных ионов. Приложение I ПРИГОТОВЛЕНИЕ РАБОЧИХ РАСТВОРОВ И РЕАКТИВОВ 1. Фенолфталеин
Взять 60 мл 90-100%-ного спирта, добавить 40 мл дистиллированной воды и растворить в нем I г порошкообразного фенолфталеина. Хранить раствор фенолфталеина в колбе с притертой колбой.
2. Метиловый оранжевый 0,1 %-ый индикатор метиловый оранжевый готовится растворением 0.1 г соли метилоранжа в мерной колбе емкостью 100 мл и доведением водой до метки.
3. Хромат калия (К2СГО4)
5 г соли хромата калия растворяется в мерной колбе емкостью 100 мл и доводится дистиллированной водой до метки.
4. Хромоген черный (эриохром черный Т)
Смешивается 1 весовая часть хромогена и 99 весовых частей хромогена черного хлорида натрия. Смесь хранить в емкости с притертой пробкой.
5. Мурексид
Смешивается 0,2 в.ч. мурексида и 99,8 в.ч. хлорида натрия. Смесь хранить в чистой сухой емкости с пробкой.
6. Аммиачный буферный раствор (рН~ 11)
Смешать 400 мл 25%-ного химически чистого аммиака со 100 мл 20%-ного хлористого аммония, добавить 10 г NaOH и 7 г КОН. После этого довести смесь до 1 л водой.
7.0,02 Н раствор H2SO4 В мерную колбу емкостью 1 л налить дистиллированной воды до половины, кислоту (0,56 мл) тонкой струйкой при перемешивании влить в колбу с водой и долить водой до метки. Кислота H2SO4 концентрированная плотностью 1,84 г/см3.
8.0,1 Н раствор НС1
В мерную колбу емкостью 1 л налить дистиллированной воды до половины, кислоту (8,2 мл) тонкой струйкой при перемешивании влить в колбу с водой и долить водой до метки. Исходная кислота - концентрированная плотностью 1,19 г/см3.
9. 0,1 Н раствор азотнокислого серебра Для приготовления 0,1 раствора отвесить 17 г AgNО3 и высыпать в чистую мерную колбу емкостью 1 л. Долить дистиллированной водой до метки. Хранить в темном месте в затемненной колбе с пробкой. 10. 0,05 Н раствор хлорида бария
5,21 г сухого хлорида бария поместить в чистую мерную колбу емкостью 1 л. Налить в небольшом объеме воды, затем довести до метки дистиллированной водой.
11. 0.05 Н раствор трилона Б
Навеску трилона Б 9,3065 г поместить в мерную литровую колбу, растворить в небольшом объеме воды, затем довести до метки дистиллированной водой.
12. 1 Н раствор NaOH или КОН
Отвесить 40 г NaOH или 56 г КОН, поместить в литровую колбу, растворить щелочь в небольшом количестве дистиллированной воды, охладить, довести до метки и перемешать.
13. 0,05 Н раствор MgCl2 2,108 г MgCl2 поместить в мерную колбу емкостью 1 л, смочить навеску водой и налить 5 мл НС1 (=1,19 г/смЗ). По окончании бурного выделения CO2 прибавлять по каплям 10%-ный раствор НС1 до полного растворения карбонатов. Довести его дистиллированной водой до метки.
14. 10%-ный раствор НС1
В мерную литровую колбу налить до половины воды, затем тонкой лруйкой 236,6 мл соляной кислоты плотностью 1,19 г/смЗ.Охладить, довести водой до метки.
15.10%-ный раствор NaOH или КОН
Отвесить 10 г NaOH или КОН, поместить в мерную колбу емкостью 100 мл, растворить щелочь в небольшом количестве воды, охладить и довести до метки.
Приложение 2
МЕТОДИКА ОПРЕДЕЛЕНИЯ ХЛОРИДОВ МЕРКУРИМЕТРИЧЕСКИМ МЕТОДОМ
Метод основан на том, что ион двухвалентной ртути образует с хлор-ионом растворимый, но малодиссоциирующий хлорид ртути II:
Эквивалентная точка устанавливается с дифенилкарбазоном, образующим с ионами двухвалентной ртути соединение, окрашенное в фиолетовый цвет. На результаты определения Сl- влияет рН титруемого раствора, величина которого контролируется индикатором бромфеноловым синим в пределах 3,0-3,5.
Реактивы: 0,05 Н азотная кислота (готовится разведением 3,5 мл концентрированной HNO3 водой до 1 л); раствор индикатора (0,5 г дифенилкарбазона и 0,05 г бромфенолового синего переносят в мерную колбу емкостью 100 мл и разбавляют до метки 95%-ным раствором этилового спирта); 0,1 Н Нg(NОз)2 (16,3 г ртути азотнокислой растворяют в 100 мл дистиллированной воды, содержащей 1-1,5 мл концентрированной НNОз, и разбавляют раствор водой до 1 л).
Порядок работы
В коническую колбу отмеривают исследуемую воду с таким расчетом, чтобы в ней содержалось не более 1-2 мг-экв С1-. Разбавляют дистиллированной водой до 50 мл, прибавляют 10 капель индикатора, состоящего из смеси бромфенолового синего и дифенилкарбазона. Затем нейтрализуют раствор 0,05Н раствором HNO3 до перехода окраски в желтый цвет, после чего прибавляют еще 0,5 мл 0,05 Н раствора НNOз и титруют по каплям 0,1Н раствором Нg(NОз)2 до сине-фиолетового цвета. Расчет ведется по формулам аналогично аргенто-метрическому методу.
ЛАБОРАТОРНАЯ РАБОТА N 4
ИССЛЕДОВАНИЕ КИНЕТИКИ КОАГУЛЯЦИИ И ФЛОКУЛЯЦИИ В СЛАБОСТРУКТУРИРОВАННЫХ ГЛИНИСТЫХ СУСПЕНЗИЯХ
Технологические свойства буровых растворов в значительной мере определяются их устойчивостью. Различают два вида устойчивости дисперсных систем: кинетическую или седиментационную и агрегативную. КИНЕТИЧЕСКАЯ устойчивость - устойчивость по отношению к силе тяжести (способность дисперсных частиц удерживаться во взвешенном состояний под влиянием броуновского движения), зависящая от дисперсности частиц, вязкости дисперсионной среды, а также разности плотностей дисперсионной среды и дисперсной фазы. АГРЕГАТИВНАЯ устойчивость - способность дисперсной системы сохранять исходную дисперсность. Агрегативная неустойчивость дисперсных систем приводит к коагуляции дисперсной фазы, т.е. слипанию частиц под действием межмолекулярных сил притяжения (рисунок б). В результате слипания частиц в дисперсной системе образуются крупные агрегаты (коагуляты). В этом случае агрегативная неустойчивость сопровождается седиментационной и в зависимости от плотности коагуляты либо выпадают в осадок, либо всплывают. Таким образом, коагуляция - это процесс слипания частиц под действием молекулярно-поляризационных сил и образования их агрегатов с последующей потерей системой седиментационной устойчивости.
Рис. 6. Схема образования коагулятов в суспензиях натриевого (а) и кальциевого бентонита (б) В глинистых суспензиях различной степени модификации агрегативная устойчивость определяется как наличием электростатического барьера, обусловленного силами отталкивания, так и существованием развитого адсорбционно-гидратного слоя, представляющего собой упруго-вязко-пластачную прослойку между частицами. Для гидрофобных дисперсных систем, согласно теории ДЛФО (рисунок 7), элементарный акт коагуляции происходит вследствие взаимодействия частиц в ближней или дальней потенциальных "ямах", в которых превалируют силы молекулярного притяжения. Причем, ближнее взаимодействие, которое возможно при небольших значениях потенциального барьера и малой глубине дальней "ямы" является необратимым. При дальнем взаимодействии, имеющим место при большой глубине второго минимума, образуются рыхлые, легко разрушаемые агрегаты, т.е. коагуляция обратима. Углубление коагуляции дисперсных частиц возможно под действием тепла и холода, электрического и магнитного полей, механических сил и химических реагентов. Наиболее сильное влияние на коагуляцию дисперсных систем оказывают электролиты. Причем, по коагулирующему действию катионы располагаются в лиотропный ряд:
Аl3+ > Fe3+ > Са2+ > Mg2+ >К+> NH4+ > Na+ > Li+
При воздействии электролитов на дисперсные системы различают концентрационную и нейтрализационную коагуляцию. КОНЦЕНТРАЦИОННАЯ происходит за счет увеличения содержания электролита в дисперсной системе, которая приводит к сжатию диффузной части ДЭС, снижению величины потенциального барьера и увеличению глубины второго минимума, что приводит к возрастанию вероятности дальней агрегации, НЕЙТРАЛИЗАЦИОННАЯ коагуляция наблюдается у дисперсных частиц с низкими значениями потенциала поверхности и происходит в результате адсорбции потенциалоопределяющих ионов и снижению электрического заряда (ослабевают электростатические силы отталкивания).
Рис. 7. Изменение энергии взаимодействия двух частиц
Коагуляция электролитами в модифицированных системах обусловлена дегидратацией частиц и тем сильнее, чем больше концентрация электролита и выше валентность коагулирующего иона. С другой стороны, существование адеорбционно-гидратного слоя уменьшает возможность приближения частиц на малые расстояния и ближней коагуляции. В основном, в глинистых суспензиях преобладает дальнее взаимодействие, что имеет важное значение при получении глинистых растворов из модифицированных глинопорошков. Если коагуляция - это потеря агрегативной устойчивости за счет слипания дисперсных частиц под действием межмолекулярных сил притяжения, то флокуляция - это такой процесс агрегатирования, когда присоединение их друг к другу осуществляется посредством, так называемых,"полимерных мостиков", образованных высокомолекулярными соединениями - флокулянтами. Связанные полимерными мостиками частицы взаимодействуют между собой, образуя флокулы, которые могут привести к потере се-диментационной устойчивости и разделению фаз (рисунок 8). В качестве флокулянтов используются, в основном, линейные полимеры, которые по своему активному началу делятся на: 1 - анионоактивные полиэлектролиты, образующие при диссоциации сложный полимерный органический анион и простой катион (Na+,K+; NH4+). К ним относится полиакрилат натрия, КМЦ и др. 2 - катионоактивные.полиэлектролиты, диссоциирующие на органический поликатион и простой анион (Сl-,SO42-, СНзСОО). Примером может служить поливинилфталат. 3) - аморфные соединения, функциональные группы которых могут быть кислого и основного характера и иметь карбоксильную СОО и амидную (-ONH2+) группы. Например, гипан, гидролизованнь1й по-лиакриламид, метас и др. 4) - неионогенные вещества, которые в водной среде не диссоциируют (полиоксиэтилен). Флокуляция глинистьгх частиц осуществляется в результате адсорбции высокополимера на нескольких соседних частицах как посредством электростатаческого взаимодействия, так и ионного обмена. Если в качестве флокулянта используются неионогенные вещества, то образование мостиков происходит посредством водородных связей между недиссоциированной группой полимера и гидроксильными группами или атомами водородов на поверхности алюмосиликатов. Считается, что максимальная флокуляция соответствует половинному заполнению поверхностного слоя макромолекулами. С повышением концентрации полимера в дисперсной системе флокуляция понижается и, при достижении определенной концентрации флокулянта, исчезает, а система стабилизируется. Причем, для некоторых полимеров характерно свойство избирательности (селективности) по отношению к различным минералам: они флокулируют одни вещества и могут стабилизировать другие. Это зависит от химической природы поверхности минералов (дзета - потенциала), а также от их дисперсности. А так как химическая природа минеральных частиц (глинистых) мало отличается по типу потенциалоопределяющих ионов и знаку заряда, то разница по флокулирующим концентрациям объясняется второй причиной. Увеличить разлет концентраций можно введением неорганических электролитов, в основном, гидролизуемых коагулянтов (хлориды и сульфаты Al и Fe). Кроме того, интенсивность флокуляции дисперсных частиц полимерами зависит от свойств флокулянта: молекулярной массы (чем больше молекулярная масса,тем эффективнее действует флохулянт и при меньших концентрациях); степени гидролиза (изменение заряда поверхности флокулянта может усиливать или уменьшать адсорбцию его на дисперсных частицах); щелочности среды (адсорбционные свойства зависят от гибкости цепей макромолекул и тем больше, чем сильнее развернутость), а также от содержания твердой фазы. Флокулирующие свойства полимеров используются в полимерных буровых растворах, с целью поддержания пониженной концентрации твердой фазы. Таким образом, для флокуляции характерны невысокие удельные расходы реагентов-флокулянтов, в сотни раз меньше, чем электролитов-коагулянтов. При высоких концентрациях флокулянтов обычно наступает стабилизация суспензий (рисунок 9а), тогда как при высоких концентрациях электролита в суспензии всегда наблюдается коагуляция (рисунок 9б).
Рис, 8. Схема образования флокул: 1 - глинистая частица, 2 гидратная оболочка, 3 - полимер Изучение кинетики коагуляции электролитами и флокуляции полимерами глинистых суспензий можно проводить, используя метод фильтрации и метод седиментации. Фильтрационный метод исследования может быть осуществлен на любом фильтр-прессе и заключается в определении объема отфильтровавшейся жидкости за определенное время, или изменение этого объема через некоторые промежутки времени (кинетика изменения объема). При этом скорость фильтрации, зависящая от дисперсности твердой фазы, вязкости среды свободной воды и сжимаемости корки, может служить мерой оценки того или иного коагулянта (флокулянта) при условии, что T0=consT, р = const.
- а) б)
Рис. 9. Изменение отстоя глинистых суспензий. Более простым и распространенным является метод седиментации, который позволяет провести качественную оценку процессов посредством наблюдения за перемещением уровня осадка суспензии или осветленной части суспензии (отстой) в стеклянных цилиндрах. При этом сравнение производят или в долях процентов за одинаковое время или используют скорость осаждения, которая зависит от размеров и плотности агрегатов и от вязкости дисперсионной среды. Наблюдение за осадком позволяет определить структуру коагулятов и флокул. Цель работы: Дать сравнительную оценку коагулирующих или флокулирующих свойств неорганических электролитов и полимеров по отношению к глинистым суспензиям различного минерального состава. Приборы и материалы: для проведения опытов используются мерные цилиндры по 100 или 250 мм. В качестве дисперсной фазы должны применяться мономинеральные разности глин: монтмориллонит (бентонит), каолин, гидрослюда. С этой целью можно рекомендовать саригюхский бентонит, глуховецкий каолин, нефтеабадскую (гидрослюдистую) глину. Содержание твердой фазы в суспензии - 1% (мае). Коагулянтами служат соли одно-, двух и трехвалентных металлов (например, хлориды натрия, кальция и алюминия). Флокулянтами -акриловые полиэлектролиты (гипан или ГПАА). Коагулянты и флокулянты добавляются в суспензию в виде водных растворов (табл. 6). Порядок выполнения работы;
1. Определить по формулам количество добавляемого электролита (полимера) в каждый из цилиндров (согласно задания): п -С
где V, Vx.p.- обьемы соответственно цилиндра (100 или 250 мл), раствора электролита или полимера (мл); с - содержание электролита (полиэлектролита) в суспензии г/л; п - концентрация водного раствора электролита (пошолектролита) в г/л. 3.
3. Смеси перемешать опрокидыванием или встряхиванием в течение 1 минуты. 4. Цилиндры поставить на лабораторный стол, засечь время и определить отстой через 1,2,3,5,10,15,20 и 30 минут от начала опыта. 5. Результаты исследования кинетики коагуляции и флокуляции занести соответственно в таблицы 7 и 8. Таблица 7. Тип суспензии - Коагулянт –
Таблица 8. Тип суспензии - Флокулянт -
6. Результаты обработки данных табл. 7 и 8 необходимо представить в виде графических зависимостей; - отстой за 30 мин в зависимости от концентрации коагулянта (Ск) или флокулянта (Сф):
О30 =f(Cк); О30 =f(Сф) - изменение отстоя при обработке коагулянтом (Ок) или флокулянтом (Оф) во времени:
Контрольные вопросы:
1. Чем отличается коагуляция от флокуляции? 2. Вещества какой природы коагулируют (флокулируют) дисперсную систему? 3. Объясните полученные результаты. 4. Дайте краткую характеристику реагентам, используемым Вами в работе. 5. Когда в процессе бурения наблюдаются явления коагуляции и флокуляции?
ЛАБОРАТОРНАЯ РАБОТА N 5
ИССЛЕДОВАНИЕ СВОЙСТВ КОАГУЛЯЦИОННЫХ СТРУКТУР В ПРОМЫВОЧНЫХ ЖИДКОСТЯХ
Агрегативная неустойчивость дисперсных систем приводит к коагуляции дисперсной фазы, в результате которой образуются крупные агрегаты-коагуляты. Эти агрегаты седиментационно неустойчивы и могут выпадать в осадок или всплывать. В промывочных жидкостях, представляющих, как правило, концентрированные дисперсные системы, разделение фаз не столь явно и визуально не всегда заметно. Элементарный акт коагуляции в дисперсной системе происходит вследствие взаимодействия частиц в ближнем или дальнем минимумах потенциальной энергии, в которых силы межмолекулярного притяжения преобладают над силами электростатического отталкивания (рис. 7, лабораторная работа N 4). Взаимодействие в ближнем минимуме возможно при небольших значениях потенциального барьера и малой глубине дальней потенциальной "ямы". Так как значение энергии в ближнем минимуме обычно много больше кинетической энергии частиц, коагуляция в данном случае носит необратимый характер и сопровождается уменьшением дисперсности, удельной поверхности и седиментации дисперсной фазы. Если глубина второго минимума велика, то независимо от высоты потенциального барьера,.происходит дальнее взаимодействие частиц, фиксируемых на расстоянии порядка 0,1. - 1 мкм. Образовавшиеся пары взаимодействующих частиц совершают совместные колебательные и поступательные движения и могут присоединять другие частицы, превращаться в тройники и более сложные структуры. При достаточной концентрации дисперсной фазы система полностью структурируется» образуя сплошные пространственные сетки. Важной особенностью коагуляции во втором минимуме является сохранение частицами своей индивидуальности, а системой в целом - исходной дисперсности и удельной поверхности. Кроме того, вследствие небольшой глубины второго минимума, связи между частицами являются гибкими и не очень прочными. Поэтому агрегаты, образованные при дальнем взаимодействии, могут сравнительно легко распадаться и коагуляция получается обратимой (явление тиксотропии). В глинистых минералах различные поверхности отличаются по свойствам. Боковые ребра имеют амфотерный характер и в широком интервале рН могут нести положительный заряд. Плоские же грани глинистых минералов всегда заряжены отрицательно. Поэтому глинистые цастицы могут притягиваться и при отсутствии потенциальных минимумов, характерных для частиц с развитыми адсорбционно-гидратными слоями. В результате этих взаимодействий возникает так называемая реброгранная коагуляция глин. В реальных дисперсных системах, в т.ч. промывочных жидкостях в образовании и развитии пространственной структуры участвуют агрегаты, возникшие при коагуляции как в ближнем, так и в дальнем минимумах, а также в следствие их взаимодействия по противоположно заряженным участкам. Такие структуры называются коагуляци-онными и отличаются от конденсационно-кристаллизационньгх, образованных в результате срастания частиц за счет возникновения первичных химических связей (например, при кристаллизации твердой фазы из растворов). Известно,что основной вид промывочной жидкости представляет собой дисперсии глинистых минералов с развитой коагуляционной структурой и хорошо выраженными тиксотропными свойствами. Взаимодействие структурньгх элементов в таких системах осуществляется, в основном, за счет сил Ван-дер-Ваальса через весьма тонкие сольватные (гадратные) оболочки. Эти оболочки формируются по всей поверхности глинистых частиц, но при этом их толщина неодинакова, т.е. они развиваются по плоским граням и значительно меньше по ребрам кристаллов. В связи с этим взаимодействие между частицами происходит по центрам с наименее развитыми сольватными (гидратными) слоями (рисунок 10). Обработка глинистой суспензии полимерными реагентами линейного строения способствует формированию смешанной полимерглинистой (коагуляционно-флокуляционной) структуры, когда наряду «с действием межмолекулярных сил притяжения происходит образование мостиковой связи (рисунок 11). При этом, как правило, при достаточном количестве твердой фазы структурно-механические свойства бурового раствора усиливаются.
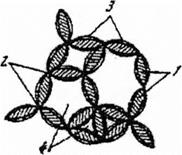
РисЛ 1. Полимер-глинистая структура: 1 - флокула, 2 - глинистая частица, 3 - полимерный мостик, 4 - молекула полимера Наличие коагуляционной структуры, обладающей механической прочностью, определяет важнейшие технологические свойства: поведение при течении, способность удерживать во взвешенном состоянии утяжелитель и выбуренную породу, необходимую величину сдвиговых давлений в начале циркуляции. Механические свойства коагуляционных структур обычно исследуют при действии внешних сил от самых малых до вызывающих разрушение. При этом происходит ориентация частиц по направлению движения, разрушение агрегатов и структур, образованных вследствие физико-химического взаимодействия. Изучение процессов деформации неразрушенных структур осуществляют с помощью метода тангенциального смещения пластинки или в приборах с коаксиальными цилиндрами. При отсутствии соответствующих средств для оценки характера деформирования структурированной промывочной жидкости и определения ее прочности через предельное статическое напряжение сдвига используют стандартные промысловые ротационные приборы СНС-2 и ВСН-3 (при частоте вращения цилиндра 0,2 об/мин). При остановках циркуляции в объеме бурового раствора образуется более или менее прочная структура, способная сопротивляться разрушению до определенного значения напряжения сдвига. Это и есть так называемая прочность геля или статическое напряжение сдвига (СНС). Оно зависит от типа и концентрации твердой фазы в системе, температуры и давления, степени коагуляции и длительности состояния покоя. После перемешивания образованные структуры разрушаются,и гели вновь превращаются в жидкости. Такие системы называют тиксотропными. Цель работы: На основе данных по изучению кинетики деформирования и изменения от времени выдержки в покое предельного статического напряжения сдвига (ПСНС) провести анализ свойств пространственных структур глинистых суспензий до и после обработки химическими реагентами. Приборы и материалы: Приборы СНС-2 или ВСН-3; кружка для бурового раствора; механическая мешалка или миксер; глинистая суспензия, химические реагенты.
Порядок выполнения работы:
L Подготовить прибор СНС-2 (ВСН-3) к работе (см. "Буровые промывочные жидкости. Часть Г); 2. Определить плотность глинистой суспензии, используя ареометр или рычажные весы (см.»Буровые промывочные жидкости. Часть I»); 3. Перемешать глинистую суспензию на лабораторной мешалке; 4. При работе на приборе СНС-2 раствор налить в зазор между цилиндрами до уровня верхней кромки подвесного цилиндра. Чтобы раствор равномерно распределялся по зазору, следует слегка поворачивать подвесной цилиндр вокруг оси. При работе на приборе ВСН-3 суспензию налить в стакан до риски. Стакан установить на подвижный столик. Столик, в свою очередь, поднять до упора и зафиксировать. Все измерения выполнять при частоте вращения 0,2 об/мин. 5. Оставить прибор в покое на 0,25 мин. 6. По истечении этого времени включить тумблер и наблюдать по показателю за вращением лимба. Вести запись его показаний (табл.9) через равные промежутки времени (через 10 сек.). Обязательно зафиксировать время достижения максимального показания и 3-4 показания после него. / Выключить электромотор, разрушить структуру промывочной жидкости вращением подвесного цилиндра вручную (СНС-2) или переключить двигатель на скорость 600 об./мин (ВСН-3). Оставить прибор в покое на 1 мин, 8. Провести замеры аналогично п.6. 9. В такой же последовательности провести исследование, оставляя прибор в покое на 3,10 и 20
|

 Ag+ + Cl = AgCl
Ag+ + Cl = AgCl 2Аg+ + СrО4 2- = Ag2CrO4
2Аg+ + СrО4 2- = Ag2CrO4 Hg2++ 2CI- HgCl
Hg2++ 2CI- HgCl









