Расчеты эквивалентов
ЗАКОН ЭКВИВАЛЕНТОВ
Эквивалент (Э) - это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода (Н+) в ионообменных реакциях или одному электрону (е-) в окислительно-восстановительных реакциях. Например, в реакции: NaOH + HCl = NaCl + H2O эквивалентом будет реальная частица - ион Na+, в реакции Zn(OH)2 + 2HCl = ZnCl2 + 2H2O эквивалентом будет являться условная (мнимая) частица 1/2Zn(OH)2. Так же, как в случае молекул, атомов или ионов, эквивалент описывают с помощью химических формул. Например, гидроксид калия во всех обменных реакциях может присоединять один ион водорода, следовательно, эквивалентом гидроксида калия будет молекула КОН. Э={КОН}. Эквивалентом соляной кислоты в ионообменных реакциях будет НСl. Э={НСl}. Цинк может окисляться только до Zn2+, следовательно, в окислительно-восстановительных реакциях эквивалентом цинка будет условная величина, половина его атома или иона, Э=1/2{Zn}. Для фосфорной кислоты Э=1/3{Н3РО4}. Это химическая формула эквивалента. Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получила название фактора эквивалентности, fЭ. Так, в рассматриваемых случаях эквивалентом гидроксида калия будет молекула КОН и fЭ(КОН) = 1, fЭ(НСl) = 1, а эквивалентом иона Zn2+ будет половина иона Zn2+, fЭ(Zn) = 1/2. Масса одного моля эквивалентов называется молярной массой эквивалентов вещества (эквивалентной массой) МЭ . Она рассчитывается, как произведение фактора эквивалентности на молярную массу вещества: МЭ =fЭ∙М (г/моль) (1) Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей. Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента, VЭ, (или эквивалентный объем) - объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Он измеряется в литрах и вычисляется (при н.у., Т0 = 273 К, Р0 = 760 мм рт. ст. или 101,3 кПа), как произведение фактора эквивалентности на молярный объем газа: VЭ = fЭ∙Vм = fЭ∙22,4 (л) (2) Физический смысл эквивалента заключается в том, что эквивалент характеризует реакционные возможности вещества: сколько именно ионов водорода или эквивалентных ему однозарядных частиц может использовать молекула (ион) вещества в ионообменных реакциях, или сколько именно электронов потребуется для превращения этой молекулы (иона) в окислительно-восстановительных реакциях (ОВР). Максимальное содержание эквивалентов в молекуле вещества, как в ионообменных реакциях, так и в ОВР можно определить по формулам, рассматривая состав соединения. Пример 1. В обменных реакциях при максимальном содержании эквивалентов в молекуле определить: а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, для следующих веществ из классов кислот, оснований и солей: Н3РО4, Са(ОН)2, Аl2(SО4)3 Решение:Для кислот, оснований и солей фактор эквивалентности в обменных реакциях при максимальном содержании эквивалентов в молекуле определяется по формуле: 1 fЭ = —— (3) n∙z где n - число функциональных групп в молекуле, z - абсолютная величина заряда функциональной группы. Функциональными группами в кислотах являются ионы водорода, в основаниях - ионы гидроксила, в солях - ионы металла. Конечно, в кислых солях также ионы Н+, а в основных - ОН-, в зависимости от реакции. Таким образом: для Н3РО4 а) fЭ = 1/3, б) Э = 1/3{Н3РО4}, в) МЭ = fЭ∙М(Н3РО4) = 1/3(3,0 + 31,0 + 4∙16,0) = 98,0/3 = 32,7 г/моль для Са(ОН)2 а) fЭ = 1/2, б) Э = 1/2{Са(ОН)2}, в) МЭ = fЭ∙М(Са(ОН)2) = 1/2(40,1 + 2∙17,0) = 74,1/2 = 37,0 г/моль. для Аl2(SО4)3 а) fЭ = 1/(2∙3) = 1/6, б) Э = 1/6{Аl2(SО4)3}, в) МЭ = fЭ∙М(Аl2(SО4)3) = 1/6(2∙27,0 + 3∙96,0) = 342/6 = 57,0 г/моль
Оксиды делятся на солеобразующие (кислотные, амфотерные, основные) и несолеобразующие. Для несолеобразующих (безразличных) оксидов СО, N2О, NО характерны окислительно-восстановительные реакции, (ОВР). В ОВР эквивалент всегда рассчитывается по изменению степени окисления. Для солеобразующих оксидов в реакциях не ОВР фактор эквивалентности определяется по формуле (3) для кислот (оснований), ангидридом которых является данный оксид. Пример 2. Определить в реакциях присоединения/разложения, не являющихся ОВР, а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, а для газов и г)объем моля эквивалентов, VЭ, при максимальном содержании эквивалентов в молекуле для следующих веществ из класса оксидов. СО2 - газ, СаО, Р2О5. Решение: СО2 - кислотный оксид, является ангидридом двухосновной угольной кислоты Н2СО3, в соответствии с чем его фактор эквивалентности составляет 1/2. а) fЭ = 1/2; б) Э = 1/2 {СО2}, в) МЭ = fЭ∙МСО2 = 1/2 (12,0 + 2∙16,0) = 44,0/2 = 22,0 г/моль. Так как СО2 - газ, определяем еще объем моля эквивалентов (эквивалентный объем): г) VЭ = fЭ ∙22,4 = 11,2 л. СаО - основной оксид, являющийся ангидридом двухкис-лотного основания Са(ОН)2, в соответствии с чем его фактор эквивалентности составляет 1/2. а) fЭ = 1/2, б) Э = 1/2{СаО}, в) МЭ = fЭ∙МСаО = 1/2(40,1 + 16,0) = 56,1/2 = 28,0 г/моль. Р2О5 - кислотный оксид, дающий при взаимодействии с водой две молекулы трехосновной фосфорной кислоты Н3РО4. по реакции: Р2О5 + 3Н2О = 2Н3РО4 Следовательно, одна молекула Р2О5 эквивалентна 6 ионам водорода, в соответствии с чем, его фактор эквивалентности находится из формулы fЭ = 1/(2∙3) и составляет 1/6. а) fЭ = 1/6, б) Э = 1/6 {Р2О5}, в) МЭ = fЭ∙МР2О5 = 1/6(2∙31,0 + 5∙16,0) = 142/6 = 23,67 г/моль
Если дана конкретная реакция, то состав эквивалента следует определять из сопоставления начальных и конечных продуктов реакции. В первую очередь следует определить, с каким типом реакции мы имеем дело: с окислительно-восстановительной реакцией (ОВР) или с не-ОВР. К последним относятся реакции, в которых не меняются степени окисления элементов, например, ионнообменные реакции и часть реакций разложения. Из определения эквивалента следует, что в зависимости от типа реакции, по разному определяется состав эквивалента вещества. В ионообменных реакциях (не-ОВР) надо рассматривать, сколько ионов водорода или эквивалентных ему частиц (Nа+, К+, ОН-, Сl- и т.д.) взаимодействует с рассматриваемым веществом. Напоминаем, что окислительно-восстановительными реакциями (ОВР), являются такие, в которых изменяются степени окисления (С.О.) элементов. В ОВР для того, чтобы определить фактор эквивалентности и правильно записать химическую формулу эквивалента, надо определить С.О. окисляющегося или восстанавливающегося элемента в данном веществе до и после реакции и определить число электронов, перемещаемых в оболочке этого элемента. Согласно определению, эквивалент составит такую часть молекулы, которая приходится на 1 электрон. Никакого учета коэффициентов в реакциях при этом не требуется. Пример 3. Определить: фактор эквивалентности, fЭ, химическую формулу эквивалента, Э, молярную массу эквивалентов, МЭ, и (для газов) молярный объем эквивалентов, VЭ, реагирующих веществ в следующих реакциях: 1. Аl(ОН)3 + 2НСl = АlОНСl2 + 2Н2О 2. 2Н2S(Г) + 3О2(Г) = 2SО2 + 2Н2О Решение. Реакция 1 является ионообменной В ней Аl(ОН)3 превращается в АlОНСl2, т.е. в молекуле гидроксида алюминия замещаются два иона ОН-, каждый из которых эквивалентен одному иону водорода, на ионы Сl-. Следовательно, ее эквивалент в данной конкретной реакции составляет 1/2 молекулы Аl(ОН)3. fЭ =1/2; Э= 1/2{Аl(ОН)3}; МЭ = fЭ∙МАl(ОН)3 = 1/2(27,0 + 3∙17,0) = 39 г/моль. Молекула НСl в любой ионообменной реакции может отдавать только 1 ион водорода Н+, следовательно, содержит 1 эквивалент. fЭ=1, Э = {НСl}. МЭ = fЭ ∙ МНСl = 1∙(1,0 + 35,5) = 36,5 г/моль. Реакция 2 окислительно-восстановительная. В ней сера меняет свою С.О. от -2 (в Н2S) до +4 (в SО2). Перемещаются 6 электронов. Следовательно, в данной конкретной реакции молекула сероводорода содержит 6 эквивалентов. fЭ = 1/6, Э = 1/6 {Н2S} МЭ = fЭ ∙ МН2S = 1/6(2,0 + 32,1) = 5,7 г/моль. Сероводород - газ. VЭ = fЭ ∙22,4 = 3,73 л. Кислород в реакции 2 меняет свою С.О. от 0 до -2. При этом у каждого атома кислорода перемещаются 2 электрона. В молекуле кислорода О2 неразрывно связаны 2 атома. Следовательно, молекула кислорода содержит 4 эквивалента. fЭ = 1/4, Э = ¼{ О2 } МЭ = fЭ∙МО2 = 1/4(2∙16) = 8 г/моль. Кислород - газ. VЭ = fЭ ∙22,4 = 5,6 л. Итак, обобщая вышеизложенный материал, расчет фактора эквивалентности для некоторых классов химических соединений можно представить в виде таблицы 1.
Таблица 1 - Расчет фактора эквивалентности
|

 ,
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
,
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
 ,
где n(H+) – число ионов водорода (основность кислоты)
,
где n(H+) – число ионов водорода (основность кислоты)
 ,
где n(ОH–) – число гидроксид-ионов (кислотность основания)
,
где n(ОH–) – число гидроксид-ионов (кислотность основания)
 ,
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка
,
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка
 ,
где
,
где 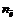 – число электронов, участвующих в процессе окисления или восстановления
– число электронов, участвующих в процессе окисления или восстановления
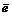 → Fe0
fЭ(Fe2+) =1/2;
MnO4–+8H++ 5 =Mn2+ + 4H2O
fЭ(MnO4–) = 1/5
→ Fe0
fЭ(Fe2+) =1/2;
MnO4–+8H++ 5 =Mn2+ + 4H2O
fЭ(MnO4–) = 1/5
 ,где z – заряд иона
,где z – заряд иона



