Рекомбинация атомов водорода
Рекомбинация атомов водорода обсуловлена силами межатомного взаимодействия. Происхождение сил, вызывающих притяжение электрически нейтральных атомов друг к другу, было объяснено в 1930 году Ф.Лондоном. Межатомное притяжение возникает вследствиефлуктуации электрических зарядов в двух атомах, находящихся близко друг от друга. Поскольку электроны в атомах движутся, то каждый атом обладает мгновенным электрическим дипольным моментом, отличным от нуля. Мгновенный диполь (электродинамика) на одном атоме наводит противоположно направленный диполь в соседнем атоме. Наступает синхронизация колебаний двух атомов – двух осцилляторов, частоты которых совпадают. Результатом этого процесса является образование молекулы водорода. Наличие мгновенного электрического дипольного момента у атома водорода выражается в характерной особенности атома водорода, проявляющейся в крайней реакционной способности атомарного водорода и склонности его к рекомбинации. Время существования атомного водорода составляет около 1 сек. Под давлением в 0.2 мм рт. ст. Рекомбинация атомов водорода имеет место, если образующаяся молекула водорода быстро освобождается от избытка энергии, выделяющейся при взаимодействии атомов водорода путём тройного столкновения. Соединение атомов водорода в молекулу протекает значительно быстрее на поверхности различных металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул водорода, и нагревается до очень высоких температур. Тепловой эффект реакции образования молекулярного водорода из атомов водорода составляет 103 ккал/моль. На принципе рекомбинации атомов водорода разработана атомно-водородная сварка. Между двумя вольфрамовыми стержнями создаётся электрическая дуга, через которую по облегчающим стержни трубкам пропускается ток водорода. При этом часть молекул водорода распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещаемой на небольшом расстоянии от дуги. Металл может быть таким путём нагрет до температуры выше 3500° C [7]. Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения водорода в атомарное состояние (α) в зависимости от абсолютной температуры (T) представлены в таблице[8]:
2.Атом водорода в квантовой механике
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелияНе+, двукратно ионизованного лития Li++и др.) сводится к задаче о движении электрона в кулоновском поле ядра. Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1),
где r — расстояние между электроном и ядром. Графически функция U (r) изображена жирной кривой на рис. U (r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает. Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение
где т — масса электрона, Е — полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения 2.1.Энергия.
В теории дифференциальных уравнений доказывается, что уравнения типа
т. е. для дискретного набора отрицательных значений энергии. Таким образом,как и в случае «потенциальной ямы» с бесконечно высокими «стенками» и гармонического осциллятора, решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е 1, E 2, Е 3 ,... показаны на рис. 302 в виде горизонтальных прямых. Самый нижний уровень Е 1, отвечающий минимальной возможной энергии, — основной, все остальные (Еn >Е 1, n = 2, 3,...) — возбужденные. При Е <0 движение электрона является связанным — он находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при n =¥ E ¥ = 0. При Е >0 движение электрона является свободным; область непрерывного спектра Е >0 (заштрихована на рис. 302) соответствует ионизованному атому. Энергия ионизации атома водорода равна
Однако если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
2.2.Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера Главное квантовое число n, согласно
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
где l — орбитальное квантовое число, которое при заданном n принимает значения
т. е. всего n значений, и определяет момент импульса электрона в атоме. Из решения уравнений Шредингера следует также, что вектор L l момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llx на направление z внешнего магнитного поля принимает квантованные значения, кратные ћ:
где тl — магнитное квантовое число, которое при заданном l может принимать значения
т. е. всего 2 l +1 значений. Таким образом, магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2 l +1 ориентации. Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом п на 2 l +1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено в 1896 г. голландским физиком П. Зееманом (1865—1945) и получило название эффекта Зеемана. Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка*. * И. Штарк (1874—1957) — немецкий физик.
Хотя энергия электрона и зависит только от главного квантового числа п, но каждому собственному значению Еn (кроме Е 1 ) соответствует несколько собственных функций
Квантовые числа и их значения являются следствием решений уравнений Шредингера и условий однозначности, непрерывности и конечности, налагаемых на волновую функцию y. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема. Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа п и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве. В атомной физике, по аналогии со спектроскопией, состояние электрона, характеризующееся квантовыми числами l= 0, называют s -состоянием (электрон в этом состоянии называют s -электроном), l =1 — p -состоянием, l= 2 — d -состоянием, l =3 — f -состоянием и т. д. Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа. Например, электроны в состояниях n =2 и l =0 и 1 обозначаются соответственно символами 2 s и 2 р. Для примера На рис. 303 приведено распределение электронной плотности (формы электронного облака) для состояний атома водорода при n =1 и п= 2, определяемое |
2.3.Спектр.
Квантовые числа n, l и ml позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора. В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света. Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центрально-симметричном поле ядра, могут осуществляться только такие переходы, для которых: 1) изменение орбитального квантового числа D l удовлетворяет условию
2) изменение магнитного квантового числа D ml удовлетворяет условию
В оптических спектрах указанные правила отбора в основном выполняются. Однако в принципе могут наблюдаться и слабые «запрещенные» линии, например возникающие при переходах с D l = 2. Появление этих линий объясняется тем, что строгая теория, запрещая дипольные переходы, разрешает переходы, соответствующие излучению более сложных систем зарядов, например квадруполей. Вероятность же квадрупольных переходов (переходы с D l =2) во много раз меньше вероятности дипольных переходов, поэтому «запрещенные» линии и являются слабыми. Учитывая число возможных состояний, соответствующих данному n, и правило отбора, рассмотрим спектральные линии атома водорода (рис. 304): серии Лаймана соответствуют переходы
серии Бальмера —
и т. д.
Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома и может происходить только при сообщении атому энергии извне, например за счет поглощения атомом фотона. Так как поглощающий атом находится обычно в основном состоянии, то спектр атома водорода должен состоять из линий, соответствующих переходам 1 s®np (n = 2, 3,...), что находится в полном согласии с опытом.
3.Линейчатый спектр атома водорода
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода. Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
где R '=1,10×107 м–1 — постоянная Ридберга.* Taк как n = c / l, то формула может быть переписана для частот:
где R=R'c= 3,29×1015 с–1 — также постоянная Ридберга. * И. Ридберг (1854—1919) — шведский ученый, специалист в области спектроскопии.
Из выражений В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
В инфракрасной области спектра были также обнаружены:
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенном формулой Бальмера:
где т имеет в каждой данной серии постоянное значение, m = 1, 2, 3, 4, 5, 6 (определяет серию), п принимает целочисленные значения начиная с т +1 (определяет отдельные линии этой серии). Исследование более сложных спектров — спектров паров щелочных металлов (например, Li, Na, К) — показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям бальмеровской серии. Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным. 4.Спектр атома водорода по Бору
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга. Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение
где n = 1, 2, 3,.... Из выражения Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым боровоским радиусом (а), равен
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода. Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (тev 2 / 2) и потенциальной энергии в электростатическом поле ядра (– Ze 2/(4pe0 r)):
Учитывая квантованные для радиуса n -й стационарной орбиты значения
где знак минус означает, что электрон находится в связанном состоянии. Из формулы Придавая n различные целочисленные значения, получим для атома водорода (Z = 1), согласно формуле Энергия атома водорода с увеличением n возрастает и энергетические уровни сближаются к границе, соответствующей значению n = ¥. Атом водорода обладает, таким образом, минимальной энергией (E 1 = –13,55 эВ) при n = 1 и максимальной (Е ¥ = 0) при n = ¥. Следовательно, значение Е ¥ = 0 соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора,при переходе атома водорода (Z= 1) из стационарного состояния л в стационарное состояние т с меньшей энергией испускается квант
откуда частота излучения
где R = mee 4/(8 h 3 Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода. Это совпадение убедительно доказывает правильность полученной Бором формулы Подставляя, например, в формулу
Спектр поглощения атома водорода является линейчатым, но содержит при нормальных условиях только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n = 1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана). Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой — основывается на квантовых постулатах). В теории Бора рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, однако эта теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода.
4.1.Нахождение энергии электрона из модели Бора
Вычислим уровни энергии атома водорода без учёта тонкой структуры, используя простую модель атома Бора. Для этой цели можно сделать грубое допущение электрона, двигающегося по круговой орбите на фиксированном расстоянии. Приравнивая кулоновскую силу притяжения Здесь Отсюда кинетическая энергия электрона
где Потенциальная его энергия
Полная энергия, соответственно, равна
Для нахождения радиуса rn стационарной орбиты с номером n рассмотрим систему уравнений, в которой второе уравнение есть математическое выражение первого постулата Бора
Отсюда получаем выражение для радиуса стационарной орбиты с номером n:
Радиус первой орбиты оказывается равным Подставляя это значение в выражение для энергии, получим, что
Отсюда мы можем найти волновое число (по определению это обратная длина волны или число длин волн, укладывающихся на 1 см) фотона, излучаемого атомом водорода за один переход из возбужденного состояния с главным квантовым числом
где 5.1s-Состояние электрона в атоме водорода.
1 s -Состояние электрона в атоме водорода является сферически-симметричным, т. е. не зависит от углов q и j. Волновая функция y электрона в этом состоянии определяется только расстоянием r электрона от ядра, т. е. y = y 100(r), где цифры в индексе соответственно указывают, что п= 1, l= 0 и ml =0. Уравнению Шредингера для 1 s -состояния электрона в атоме водорода удовлетворяет функция вида
где, как можно показать, Благодаря сферической симметрии y -функции вероятность обнаружения электрона на расстоянии r одинакова по всем направлениям. Поэтому элемент объема d V, отвечающий одинаковой плотности вероятности, обычно представляют в виде объема сферического слоя радиусом r и толщиной d r: d V =4p r 2d r. Тогда, согласно условию нормировки вероятностей с учетом
После интегрирования получим
Подставив выражение в формулу
Вероятность обнаружить электрон в элементе объема равна
Подставив в эту формулу волновую функцию
Вычислим те расстояния r max от ядра, на которых электрон может быть обнаружен с наибольшей вероятностью. Исследуя выражение d W/ d r на максимум, получим, что r max= a. Следовательно, электрон может быть обнаружен с наибольшей вероятностью на расстояниях, равных боровскому радиусу, т. е. имеется равная и наибольшая вероятность обнаружения электрона во всех точках, расположенных на сферах радиуса а с центром в ядре атома. Казалось бы, квантово-механический расчет дает полное согласие с теорией Бора. Однако, согласно квантовой механике, плотность вероятности лишь при r=а достигает максимума, оставаясь отличной от нуля во всем пространстве (рис. 305). Таким образом, в основном состоянии атома водорода наиболее вероятным расстоянием от электрона до ядра является расстояние, равное боровскому радиусу. В этом заключается квантово-механический смысл боровского радиуса.
|




 обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл. имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции y, только при собственных значениях энергии
имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции y, только при собственных значениях энергии

 , определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl.
, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl. , определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы:
, определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: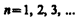



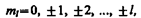
 , отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Так как при данном п орбитальное квантовое число l может изменяться от 0 до п –1, а каждому значению l соответствует 2 l +1 различных значений ml, то число различных состояний, соответствующих данному п, равно
, отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Так как при данном п орбитальное квантовое число l может изменяться от 0 до п –1, а каждому значению l соответствует 2 l +1 различных значений ml, то число различных состояний, соответствующих данному п, равно





 (209.1)
(209.1)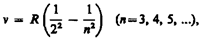
 и
и 
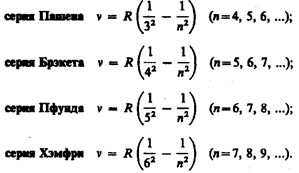

 , предложенное Резерфордом, и уравнение
, предложенное Резерфордом, и уравнение  , получим выражение для радиуса n -й стационарной орбиты:
, получим выражение для радиуса n -й стационарной орбиты:
 следует, что радиусы орбит растут пропорционально квадратам целых чисел.
следует, что радиусы орбит растут пропорционально квадратам целых чисел.

 , получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
, получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
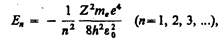 следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число n в выражении
следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число n в выражении  ,определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n =1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
,определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n =1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. ,возможные уровни энергии, схематически представленные на рис. 294
,возможные уровни энергии, схематически представленные на рис. 294  .
.
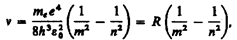 (212.4)
(212.4) ).
).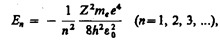 для энергетических уровней водородоподобной системы.
для энергетических уровней водородоподобной системы. т= 1 и п= 2, 3, 4,..., получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных уровней (n = 2, 3, 4,...) на основной (m = l). Аналогично, при подстановке m = 2, 3, 4, 5, 6 и соответствующих им значений n получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 294), описанные. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
т= 1 и п= 2, 3, 4,..., получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных уровней (n = 2, 3, 4,...) на основной (m = l). Аналогично, при подстановке m = 2, 3, 4, 5, 6 и соответствующих им значений n получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 294), описанные. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
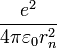 центростремительной силе
центростремительной силе  получим:
получим: 
 масса электрона,
масса электрона,  его скорость на орбите радиуса
его скорость на орбите радиуса 
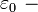 диэлектрическая проницаемость вакуума (электрическая постоянная).
диэлектрическая проницаемость вакуума (электрическая постоянная).
 расстояние от электрона до ядра.
расстояние от электрона до ядра.





 метра. Эта константа называется боровским радиусом.
метра. Эта константа называется боровским радиусом.
 в состояние с неким фиксированным главным квантовым числом
в состояние с неким фиксированным главным квантовым числом 

 постоянная Ридберга (она равна 109 737,31568539 см−1).
постоянная Ридберга (она равна 109 737,31568539 см−1).
 — величина, совпадающая с первым боровским радиусом а для атома водорода, С — некоторая постоянная, определяемая из условия нормировки вероятностей.
— величина, совпадающая с первым боровским радиусом а для атома водорода, С — некоторая постоянная, определяемая из условия нормировки вероятностей. ,
,

 , определим нормированную волновую функцию, отвечающую 1 s -состоянию электрона в атоме водорода:
, определим нормированную волновую функцию, отвечающую 1 s -состоянию электрона в атоме водорода:

 , получим
, получим




