Поверхностные эффекты
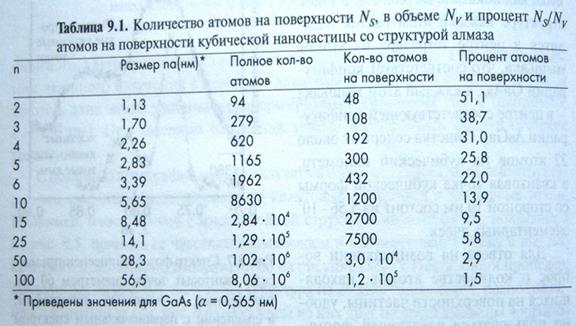
Поверхность твердого тела –это особый мир, отличный от объема тела. Здесь проявляются свойства вещества одновременно в трех фазах – твердой, жидкой и газообразной. Свойства поверхности определяют многие характеристики нанокластеров, наноструктур и наноматериалов. Площадь поверхности наночастиц Для кубической наночастицы со структурой алмаза с размерм ребра 2,83 нм, полное количество атомов 1165 шт, на поверхности 300 шт, процент на атомов на поверхности к полному числу 25,8 %. С ребром 5,65 нм, полное число атомов 8630 шт, на поверхности 1200 шт, процент атомов на поверхности 13,9%. Далее процент уменьшается с растом ребра. Т аблстр204пу л.
Многие свойства материалов состоящих из нанометровых зерен сильно зависят от о их удельной поверхности. Удельная поверхность катализатора указывается в единицах квадратных метров деленных на грамм и обозначается буквой Типичное значение
Свойства атомов и молекул на поверхности Структурные и электронные свойства атомов и молекул входящие в состав поверхности или адсорбированные на поверхности описываются квантовомеханическим методом молекулярных орбиталей. Молекулярные орбитали получают путем линейных комбинаций (ЛК) атомных орбиталей (АО), так называемый метод ЛКАО-МО. Орбитали – это решения уравнения стационарного Шредингера В качестве примера приведено образование молекулярные орбитали комплекса переходного металла путем комбинации атомных орбиталей металла и молекулярных +орбиталей лигандов. см рис суз 117. В случае поверхности твердого тела или кластера орбитали могут выступать за границы объекта и осуществлять связывание. На больших расстояниях существует только отталкивание, которое растет с приближением молекулы к поверхности. Этому соответствует разрыхляющая орбиталь. Однако когда энергия разрыхляющей орбитали достигает уровня энергии Ферми, электроны переходят на вакансии в зонах металла. В результате отталкивание сменяется притяжением и образуется связывающая орбиталь.
На поверхности монокристалла атомы образуют уменьшенное число связей, их энергия связи, уменьшается по сравнению с атомами массива. Более распространен вид поверхности связанной с высокопористыми и высокодисперсными системами. Это оксиды, силикагели, аэросил, оксид алюминия, цеолиты. Силикагель -гидратированный аморфный кремнезем формы
После процесса поликонденсации образуются наночастицы коллоидных размеров сферической формы При высушивании гидрогеля кремниевой кислоты структурная сетка между частицами
Поверхность силикагеля покрыта изолированными силанольными Оксид алюминия получают прокаливанием гидроксидов алюминия –тригидратов и моногидратов. Различают следующие типы оксидов алюминия: 1.Низкотемпературные оксиды 2.Безводные высокотемпературные оксиды алюминия получают при температуре 900-1000 оС в виде 3. Корунд
Поверхность оксидов алюминия гидроксилирована и легко модифицируется ионами металлов. Это играет важную роль в оптике, электронике, магнитных свойствах, и при адсорбции и катализе. Цеолиты - это алюмосиликаты, в которых для компенсации отрицательного заряда, возникающего при замещении иона Цеолиты встречаются в природе в виде минералов. шабазита, фожазита, морденита или синтезируются при нагреве в вакууме силикатов или алюминатов щелочных металлов. Алюмосиликатные тетраэдры
Примесные атомы на поверхности. Примесные атомы на поверхности могут изменять симметрию координации и координационного числа и собираться в нанокластеры. Ионы никеля Ионы хрома Ионы молибдена При низких концентрациях <6% ионы Ионы титана Атомы кобальта
|

 , где
, где  -площадь поверхности,
-площадь поверхности,  -плотность материала.
-плотность материала.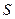 составляет
составляет  для коммерческих катализаторов. При деформации сферы до диска с тем же объемом площадь поверхности увеличивается.
для коммерческих катализаторов. При деформации сферы до диска с тем же объемом площадь поверхности увеличивается.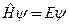 , где
, где  -оператор энергии (гамильтониан),
-оператор энергии (гамильтониан), 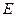 - энергия орбиталей
- энергия орбиталей  -атомные или молекулярные орбитали. В одноэлектронном приближении орбитали ищутся в виде функций
-атомные или молекулярные орбитали. В одноэлектронном приближении орбитали ищутся в виде функций 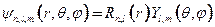 , где
, где  - радиальные функции,
- радиальные функции, 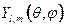 - сферические функции. Квантовому орбитальному числу
- сферические функции. Квантовому орбитальному числу  соответствуют
соответствуют  орбитали соответственно. Вид этих орбиталей различен и характеризует распределение электронной плотности. Таким образом, метод позволяет рассчитать электронную плотность молекулы или кластера.
орбитали соответственно. Вид этих орбиталей различен и характеризует распределение электронной плотности. Таким образом, метод позволяет рассчитать электронную плотность молекулы или кластера.
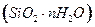 , который может быть подвергнут превращениям
, который может быть подвергнут превращениям
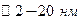 .
. сохраняется. Поры этого каркаса рассматриваются как зазоры между +частицами. На рис суз120 показано структурное изображение тонкопористых и крупнопористых силикагелей.
сохраняется. Поры этого каркаса рассматриваются как зазоры между +частицами. На рис суз120 показано структурное изображение тонкопористых и крупнопористых силикагелей.
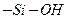 , двойными силанольными
, двойными силанольными 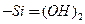 группами с концентрацией ОН 1,7-12 мкмоль/м2 или 1-7,2 групп ОН на 1 нм 2.Поверхность силикагеля модифицируется и может обладать как гидрофобными, так и гидрофильными свойствами.
группами с концентрацией ОН 1,7-12 мкмоль/м2 или 1-7,2 групп ОН на 1 нм 2.Поверхность силикагеля модифицируется и может обладать как гидрофобными, так и гидрофильными свойствами.
 с
с 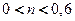 ,которые получают при температурах не выше600 оС, в виде
,которые получают при температурах не выше600 оС, в виде 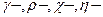 модификаций.
модификаций. модификаций.
модификаций. образуется при температурах, начиная с 1000 оС.
образуется при температурах, начиная с 1000 оС. обладает дефектной шпинельной структурой, которая стабилизирована небольшим количеством молекул воды. первичные нанокристаллиты размером 3-8 нм упакованы.так, что поры образуют щелевую или бутылочную форму.
обладает дефектной шпинельной структурой, которая стабилизирована небольшим количеством молекул воды. первичные нанокристаллиты размером 3-8 нм упакованы.так, что поры образуют щелевую или бутылочную форму.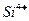 на
на 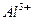 вводят щелочные металлы или водород. Это регулярные пористые структуры, заполненные в обычных условиях водой. При нагревании вода выделяется, цеолиты «кипят». Общая химическая формула цеолитов
вводят щелочные металлы или водород. Это регулярные пористые структуры, заполненные в обычных условиях водой. При нагревании вода выделяется, цеолиты «кипят». Общая химическая формула цеолитов  где
где 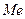 -металл или водород,
-металл или водород, 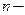 валентность.
валентность.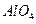 цеолитов образуют ажурные структуры, состоящие из содалитовых ячеек и кубооктаэдров образующих большие и малые полости. + см рис суз 121.
цеолитов образуют ажурные структуры, состоящие из содалитовых ячеек и кубооктаэдров образующих большие и малые полости. + см рис суз 121.
 на поверхности окиси магния
на поверхности окиси магния 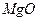 . Часть ионов на поверхности в тетраэдрическом окружении и часть в виде
. Часть ионов на поверхности в тетраэдрическом окружении и часть в виде  в соединении с гидроксилами
в соединении с гидроксилами 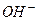
 на поверхности окиси алюминия
на поверхности окиси алюминия 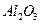 . Ионы
. Ионы 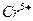 существуют виде координационно укороченной пирамиды
существуют виде координационно укороченной пирамиды 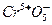 для концентраций 1-5 % хрома и вакуумирования при 300 оС. В интервале концентраций 5-10% существуют димеры типа
для концентраций 1-5 % хрома и вакуумирования при 300 оС. В интервале концентраций 5-10% существуют димеры типа 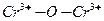 . Дальнейшее увеличение концентрации ведет к образованию оксидных кластеров хрома.
. Дальнейшее увеличение концентрации ведет к образованию оксидных кластеров хрома. на поверхности окиси алюминия
на поверхности окиси алюминия  ,
, 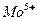 ,
,  .
. . При увеличении концентрации образуются вначале ионы
. При увеличении концентрации образуются вначале ионы  . Восстановление
. Восстановление  включающих 50-100 ионов
включающих 50-100 ионов  на поверхности
на поверхности 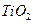 . При восстановлении поверхности рутила
. При восстановлении поверхности рутила  на поверхности вольфрама
на поверхности вольфрама 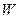 . Ограничение числа атомных связей на поверхности приводит к повышению их подвижности. Характеристикой является среднеквадратичное смещение атомов
. Ограничение числа атомных связей на поверхности приводит к повышению их подвижности. Характеристикой является среднеквадратичное смещение атомов 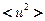 определяемо с помощью мёссбауэровской спектроскопии.
определяемо с помощью мёссбауэровской спектроскопии. 


