Катализ
Катализом называется явление увеличения скорости химической реакции, посредством добавления вещества, называемого катализатором, которое не расходуется в реакции. Гомогенные катализаторы находятся в той же газовой или жидкой фазе, что и реагенты. Гетерогенные катализаторы находятся в фазе отличной от реагентов и отделены от них фазовой границей. Гетерогенный катализ происходит с участием поверхности твердого тела. Поверхность снижает потенциальный барьер реакции. Реагенты должны хорошо сорбироваться, а продукты реакции удалятся с поверхности. Твердые катализаторы это оксиды кремния Некоторые оксиды металлов могут быть катализаторами сами или в нанесенном на подложку виде Для некоторых реакций каталитическая активность возникает из-за присутсвия кислотных центров на поверхности. Кислотный поверхностный центр Льюиса – акцепторный. Он принимает электронную пару с участием адсорбента, что приводит к уменьшению энергии системы. Кислотный поверхностный центр Бернстеда - донор протонов. Кислотность центра Бернстеда на поверхности сдвигает вправо реакцию
Поверхность снижает потенциальный барьер реакции. Реагенты должны хорошо сорбироваться, а продукты реакции удалятся с поверхности. Катализаторы в нанонауке используются при получении квантовых точек, нанотрубок и других наноструктур. Некоторые наноструктуры сами являются катализаторами для некоторых химических реакций. Большинство коммерческих катализаторов имеет пористую структуру с площадью поверхности несколько сотен м2/грамм. Катализ на кластерах переходных металлов идет легче, чем на изолированных атомах. Это связано с тем, что 1.Окислительно-восстановительным процессам способствует многоточечная адсорбция. 2.В окислительно-восстановительные реакции вовлекается несколько электронов, участие нескольких атомов металла ускоряет катализ. 3.В кластерах происходит начало объединения электронных атомных уровней в будущие зоны твердого тела. Расстояние между уровнями уменьшаются, вероятность электронных переходов, стимулирующих катализ, возрастает.
|

 или алюминия
или алюминия 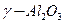 оксид титана
оксид титана 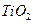 обладающие пористой или губчатой поверхностью. Поверхность катализатора покрыта каталически активным материалом, типа платина или насыщена кислотными центрами. Активным компонентом гетерогенного катализатора может быть ион переходного элемента.
обладающие пористой или губчатой поверхностью. Поверхность катализатора покрыта каталически активным материалом, типа платина или насыщена кислотными центрами. Активным компонентом гетерогенного катализатора может быть ион переходного элемента.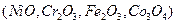 . Подготовка катализаторов к использованию включает их прокаливание при температуре несколько сотен градусов Цельсия.
. Подготовка катализаторов к использованию включает их прокаливание при температуре несколько сотен градусов Цельсия.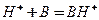 ,где
,где 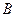 -молекула основания,
-молекула основания, 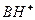 -- кислота сопряженная молекуле основания,
-- кислота сопряженная молекуле основания,  -протон для центра Бернстеда. См рис пул 238
-протон для центра Бернстеда. См рис пул 238