Лекция 6
Биологические наноструктуры. Макромолекулярные и супрамолекулярные наноструктуры. Белки, Мицеллы и везикулы. Биополимеры. Нуклеиновые кислоты. ДНК как сдублированная нанопроволока. Эмульсии. Особенности строения и область применения наноматериалов в медицине
Макромолекулярные и супрамолекулярные наноструктуры. Органические молекулы, организованные в сложные иерархические структуры имеют большое значение для материаловедения. Наноструктуры состоящие из строительных блоков в виде молекул наиболее распространены.Они относятся к мономерным, олигомерным или полимерным структурам. См рис.
Рис. Молекулярные блоки для макромолекулярных наноструктур А –линейные полимеры: 1-гибкий клубок, 2-твердый стержень, 3-цикл, 4-полиротаксан; Б- сшитые полимеры: 5-слабосшитый, 6-плотносшитый, 7-взаимнопроникающие сетки, В-разветвленные полимеры: 8-произвольно разветвленный (короткие цепи), 9-произвольноразветвленный (длин цепи) 10-гребнеобразный упорядоченно разветвленный, 11-звездообразный упорядоченно разветвленный; Г-дендритные полимеры:12проивольно сверх разветвленный, 13-контролированно разветвленный, 14-упорядоченный дендрон и дендример.
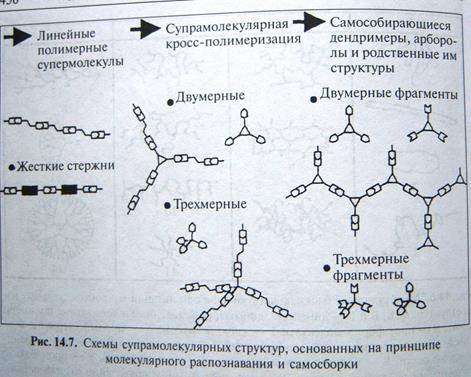
Супрамолекулярные наноструктуры представляют собой следующую за полимерами область наноматериалов, которая основана на молекулярном взаимодействии отдельных блоков за счет водородных, вандерваальсовых взаимодействиях. Такие наноструктуры позволяют целенаправленно изменять молекулярные взаимодействия и синтезировать супрамолекулярные структуры за счет самосборки мономерных компонентов. См рис.суз* +456 где представлены различные супрамолекулярные структуры, основанные на принципе молекулярного распознавания и самосборки.
Рис.Схемы супрамолекулярных структур, на основе принципа молекулярного распознанвания и самосборки.
Следующей по сложности являются наноструктуры на основе полимера, включающего нанопоры и кластеры катализатора. Поры в полимере включают мономер, который может полимеризоваться при окислении в присутствии катализатора. Когда возникают трещины в материале, распространение трещины внутрь материала приводит к разгерметизации поры. Мономер, содержащийся в поре под действием катализатора полимеризуется. Это приводит к самозалечиванию трещины. Такую наноструктуру можно рассматривать как умный (интеллектуальный) материал, который меняет свою структуру, подстраиваясь под изменяющиеся условия.
Рис Полимерный нанокомпозит, включающий нанопоры и кластеры катализатора самопроизвольно залечивает трещины в себе. В случае полимеров могут образовываться нанокристаллиты с размерами
Рис схема построения кристаллитов с гибкими и жесткими цепями.
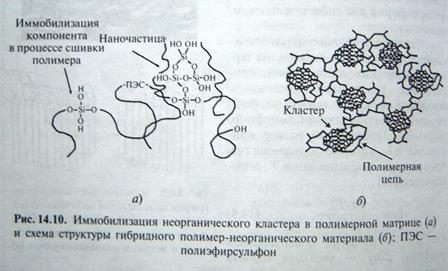
К композитным полимерным материалом относят материалы, содержащие композитные нанокластеры с переменным составом на микроскопическом уровне, полученные на основе золь-гель технологии. Оксополимеры, полученные золь гель технологией, обладают пористой структурной сеткой с размером пор 1-10 нм. Эффективным способом получения гибридных нанокомпозитов являются методы, в которых происходит одновременное формирование органической и неорганической сеток. На рис показано формирование неорганического кластера оксида кремния в полимерной матрице полиэфирсульфона, и схема возможной гибридной организации неорганического кластера в полимерной сетке. риссуз458.
Рис а) иммобилизация неорганического кластера в полимерной матрице. ПЭС-полиэфирсульфон.б)схема структуры гибридного полимер-неорганического материала.
Размеры строительных блоков и инаноструктуры.
В таблице приведен список молекулярных масс и характерные размеры биологических наночастиц по возрастанию.
Белки, Белки представляют собой биополимеры, состоящие из полипептидных цепей, построенные из 20 типов аминокислотных остатков. Полипептидные цепи образуются из аминокислот путем установления пептидных связей между аминокислотами. Гидроксильная группа На рис представлена структура шести аминокислот от самой маленькой глицин до самой большой триптофан.
Рис.Основные характеристики шести аминокислот.
На рис продемонстрирован способ соединения аминокислот в цепочки.Для формирование пептидной связи гидроксил
Рис Вверху показаны три отдельные аминокислоты до связывания. Внизу показано образование трипептидной цепи путем установления петидных связей между тремя аминокислотами.
Выделяется четыре уровня структурной организации: пул277+
Рис четыре уровня структуры белка. а)первичная структура вытянутого полипептида б)2-я структура в)3-я структура поддердивается дисульфидными связями г)4-я структура образованная двумя полипептидами.
Первичная структура вытянутая полипептидная цепь состоящая из аминокислотных остатков. Вторичная структура определяется пространственной укладкой атомов, что приводит к сворачиванию цепи в виде Третичная структура соответствует пространственной укладке вторичной структуры в глобулу(клубок) с размерами от нескольких единиц до десятков нанометров. Другие белки имеют фибриллярную (продолговатую) форму. Эта структура поддерживается дисульфидными связями. Четвертичная структура включает образования, состоящие из глобул или отдельных белковых доменов. Белки включают активные центры, обеспечивающие ту или иную функцию белка, например ферментативную или транспортную. Эти активные центры состоят из аминокислотных остатков или простатических групп с участием атомов металла. Пример Белок гемоглобина с молекулярной массой Следующий класс биополимеров -полинуклеотиды (нуклеиновые кислоты), молекулярная масса которых достигает
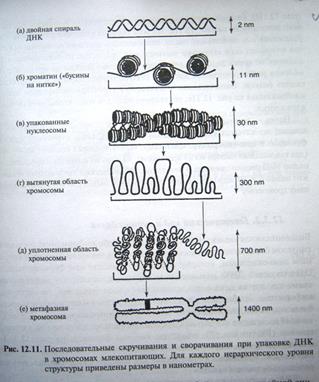
Рис. Последовательное скручивание и сворачивание при упаковке ДНК в хромосомах млекопитающих.
а) изображена вытянутая двойная спираль ДНК. б)Закручивание отрезков ДНКвокруг группы молекул белков, называемых гистонами. гистоновая бусина с намотанной на неё спиралью ДНК называется нуклеосомой, в)упакрванные нуклеосомы,в виде дисков прижатых друг к другу плотно. г)вытянутая область хромосомы д)гиперукладка –уплотненная область хромосомы. е)метафазная хромосома помещается в ядро клетки.
Разработаны методы синтеза определенных полипептидов. Используя естественный механизм синтеза белка в клетке, вводят в искусственные белки неприродные аминокислоты. Эти искусственные белки образуют складчато-цепные, слоистые или чешуйчатые кристаллы с контролируемой структурой поверхности и толщиной. Их топология отличается от формы природных белков.
|




 . Полностью выпрямленная макромолекула полимера с молекулярным весом 50 000 а.е.м. имеет длину около 450 нм. Одна и та же макромолекула проходит через ряд кристаллитов и аморфных областей. Жесткие макромолекулы должны кристаллизоваться в выпрямленной конформации с образованием кристаллитов с выпрямленными цепями. Гибкие макромолекулы складываются и возвращаются в один и тот же кристаллит со сложенными цепями. рис суз457+
. Полностью выпрямленная макромолекула полимера с молекулярным весом 50 000 а.е.м. имеет длину около 450 нм. Одна и та же макромолекула проходит через ряд кристаллитов и аморфных областей. Жесткие макромолекулы должны кристаллизоваться в выпрямленной конформации с образованием кристаллитов с выпрямленными цепями. Гибкие макромолекулы складываются и возвращаются в один и тот же кристаллит со сложенными цепями. рис суз457+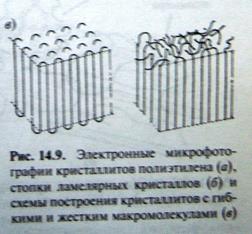

 карбоксильной группы одной аминокислоты связывается с атомом водорода
карбоксильной группы одной аминокислоты связывается с атомом водорода  аминогруппы следующей аминокислоты с установлением
аминогруппы следующей аминокислоты с установлением  пептидной связи и освобождением молекулы воды. на рис пул 276 показано образование трипептидной молекулы. Аминокислотными остатками называют аминокислоты включенные в полипептидные цепи, в отличие от свободных аминокислот. Пример пул276
пептидной связи и освобождением молекулы воды. на рис пул 276 показано образование трипептидной молекулы. Аминокислотными остатками называют аминокислоты включенные в полипептидные цепи, в отличие от свободных аминокислот. Пример пул276
 карбоксильной группы одной аминокислоты связываеися с атомом водорода
карбоксильной группы одной аминокислоты связываеися с атомом водорода  пептидной связи и освобождением молекулы воды.
пептидной связи и освобождением молекулы воды.

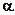 -спирали (слева) и
-спирали (слева) и  -листа (справа)
-листа (справа)
 -спирали или укладыванию в
-спирали или укладыванию в  -листы (нанопленки), которые удерживаются водородными связями.
-листы (нанопленки), которые удерживаются водородными связями.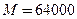 состоит из 4-х полипептидов образующих четвертичную структуру, имеет размер 3нм. Каждый полипептид содержит последовательность около 300 аминокислот и гем-молекулу
состоит из 4-х полипептидов образующих четвертичную структуру, имеет размер 3нм. Каждый полипептид содержит последовательность около 300 аминокислот и гем-молекулу  . Атом железа в геме связывает и освобождает молекулу кислорода
. Атом железа в геме связывает и освобождает молекулу кислорода  , что сопровождается изменением электронного состояния атома и изменением конформации самого белка. Красное кровяное тело (эритроцит)содержит около250 млн. молекул гемоглобина, и переносит около миллиарда молекул кислорода.
, что сопровождается изменением электронного состояния атома и изменением конформации самого белка. Красное кровяное тело (эритроцит)содержит около250 млн. молекул гемоглобина, и переносит около миллиарда молекул кислорода.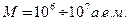 различают дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеотид более сложен, чем аминокислота. Он содержит пятичленное дезоксирибозное кольцо сахара в центре, фосфатную группу
различают дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеотид более сложен, чем аминокислота. Он содержит пятичленное дезоксирибозное кольцо сахара в центре, фосфатную группу 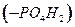 , прикрепленную с одной стороны кольца, и основание нуклеиновой кислоты, прикрепленное с другой стороны. Первичная структура полинуклеотидов представляет регулярную линейную цепь. Вторичной структурой ДНК является комплекс двух полинуклеотидных цепей связанных кислотно-фосфатными и сахарарозными группами соседних полинуклеотидов. Каждая из двух цепей образует спираль закрученную вправо относительно общей оси, так что углерод-фосфатные цепи составляют периферию молекулы. Азотистые основания направлены внутрь приблизительно под прямым углом к оси (двойная спираль Уотсона-Крика). Против каждого остатка аденина (А) в одной цепи находится остаток тимина (Т) в другой цепи. Против каждого остатка гуанина (Г) находится остаток цитозина (Ц). Комплементарные пары оснований Ц-Г и Т-А располагаются между нитями основы и связываются водородными связями. Слабость этих водородных связей позволяет спирали легко разделяться на две нити с целью транскрипции(образования РНК) или репликации (дублирования себя). Толщина отдельной нити составляет 0,34 нм, диаметр двойной спирали около 2 нм, шаг спирали равен 3.4 нм. Один период спирали содержит 10 нуклеотидных пар. Двойная спираль не образует самоорганизующихся глобул подобно белку. Молекулу ДНК можно рассматривать как двойную нанопроволоку.
, прикрепленную с одной стороны кольца, и основание нуклеиновой кислоты, прикрепленное с другой стороны. Первичная структура полинуклеотидов представляет регулярную линейную цепь. Вторичной структурой ДНК является комплекс двух полинуклеотидных цепей связанных кислотно-фосфатными и сахарарозными группами соседних полинуклеотидов. Каждая из двух цепей образует спираль закрученную вправо относительно общей оси, так что углерод-фосфатные цепи составляют периферию молекулы. Азотистые основания направлены внутрь приблизительно под прямым углом к оси (двойная спираль Уотсона-Крика). Против каждого остатка аденина (А) в одной цепи находится остаток тимина (Т) в другой цепи. Против каждого остатка гуанина (Г) находится остаток цитозина (Ц). Комплементарные пары оснований Ц-Г и Т-А располагаются между нитями основы и связываются водородными связями. Слабость этих водородных связей позволяет спирали легко разделяться на две нити с целью транскрипции(образования РНК) или репликации (дублирования себя). Толщина отдельной нити составляет 0,34 нм, диаметр двойной спирали около 2 нм, шаг спирали равен 3.4 нм. Один период спирали содержит 10 нуклеотидных пар. Двойная спираль не образует самоорганизующихся глобул подобно белку. Молекулу ДНК можно рассматривать как двойную нанопроволоку.