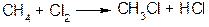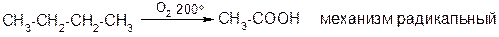Химические свойства алканов
Алканы – наиболее инертные в химическом отношении вещества. Связи С-С и С-Н малополярны и устойчивы к атаке электрофилов и нуклеофилов, они разрываются под действием радикалов.
1. Реакции радикального замещения (SR).
а) галогенирование:
механизм реакции – цепной радикальный:
Скорость реакции у первичного, вторичного и третичного углеродов различна: она увеличивается в ряду: С(1) < С(2) < С(3) (см. предыдущую схему). Причем в этом отношении хлорирование мало избирательно, бромирование гораздо более избирательно из-за меньшей активности радикала Br.
б) нитрование:
в паровой фазе при 400-500о; жидкофазное – при 110-140о (Коновалов)
2. Окисление: Алканы – одни из самых трудно окисляемых веществ. При комнатной температуре на них не действуют даже сильные окислители. При горении алканы превращаются в СО2 и Н2О. Регулируемое окисление кислородом при 200о и 90 атм. протекает в жидкой фазе с расщеплением С-С-связей и образованием смеси карбоновых кислот.
Например, промышленный способ получения уксусной кислоты:
3. Термическое расщепление и крекинг:
Крекинг очень широко применяется в переработке нефти для получения высокооктанового топлива.
Отдельные представители алканов – см. учебник.
|