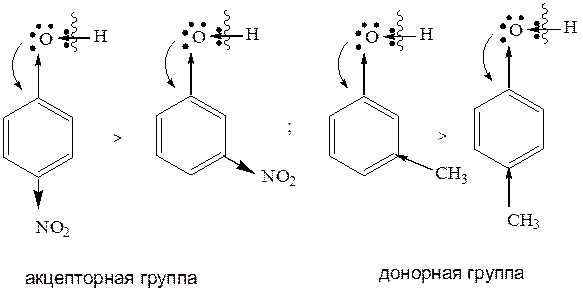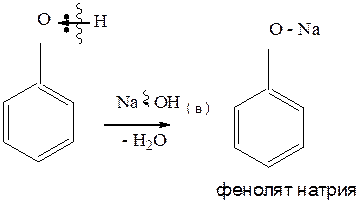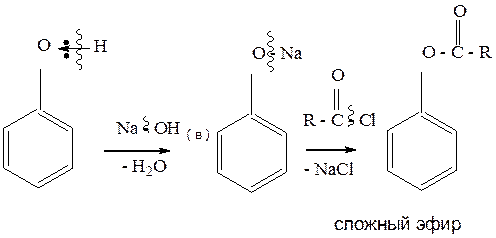Химические свойства. Для фенолов характерны следующие типы реакций:
Изомерия
Для фенолов характерна структурная изомерия, связанная с положением заместителей в кольце.

Для фенолов характерны следующие типы реакций: 3.1 Электрофильное замещение (SE). 3.2. Нуклеофильное замещение (SN). 3.3. Реакции электрофильного замещения (SE) по бензольному кольцу. 3.4. Окисление. 3.5 Качественная реакция на фенолы. 3.1.Реакции электрофильного замещения (SE). По кислотным свойствам, фенолы - более сильные соединения, чем спирты.
В фенолах акцепторное действие кольца преобладает, связь O – H в большей степени поляризуется, и водород в виде протона отщепляется легче, чем в спиртах, где углеводородный радикал играет роль донора. В спиртах электронная плотность смещается от углеводородного радикала в сторону кислорода, связь О–Н менее поляризуется - протон труднее отщепляется. Общие закономерности изменения кислотных свойств фенолов в зависимости от типа и положения заместителя. 1. Наличие в молекуле фенола акцептора (заместителя II рода) дополнительно усиливает кислотные свойства, так как акцептор смещает электронную плотность от кольца на себя; тем самым электронная плотность в кольце уменьшается, и связь О–Н сильней поляризуется - протон отщепляется легче. Наличие в молекуле донора (заместителя I рода) дополнительно снижает кислотные свойства, так как донор смещает электронную плотность в сторону кольца, тем самым, электронная плотность в кольце увеличивается, и связь О-Н в меньшей степени поляризуется - протон отщепляется труднее.
2. Чем активнее акцептор, тем кислотные свойства выше, и наоборот: чем активнее донор, – тем кислотные свойства ниже.
3. Наличие акцептора в орто- или пара-положении дополнительно увеличивает кислотные свойства, по отношению к мета-положению. Наличие донора в орто- и пара-положениях дополнительно снижает кислотные свойства по отношению к мета-положению. Необходимо отметить, что выше представлены общие закономерности изменения кислотных свойств фенолов в зависимости от радикала; более точная оценка кислотных свойств определяется по значению p K a (см. спирты, химические свойства).
3.1.1. Реакция фенолов с водными растворами щелочей. В результате реакции, образуется соль фенола – фенолят.
3.1.2. Реакция алкилирования. Алкилирование фенолов осуществляется в щелочной среде через образование фенолятов. Конечными продуктами реакции являются простые эфиры.
Пример1:
Пример 2:
3.1.3. Реакция ацилирования. Ацилирование фенолов осуществляется в щелочной среде через образование фенолятов. Конечными продуктами реакции являются сложные эфиры.
Пример1:
Пример 2:
3.2. Реакции нуклеофильного замещения (SN). 3.2.1. Реакция с пятихлористым фосфором. Наличие в молекуле сильных электроноакцепторных групп приводит к замещению группы ОН на галоген.
3.3. Реакции электрофильного замещения по бензольному кольцу. Так как группа ОН – ориентант первого рода, она ориентирует последующее замещение в орто- и пара-положения. (см. лекцию арены, химические свойства). Ниже приводится пример данной реакции. Все остальные реакции рассмотрены в теме арены. Пример:
3.4. Реакции окисления. При действии сильных окислителей (хромовая смесь и др.) фенол окисляется достаточно легко.
3.5. Качественная реакция на фенолы. Взаимодействие фенолов с треххлорным железом (FeCl3) приводит к образованию комплексного соединения с чернильной окраской.
|