ГЛАВА 2.МОИ УРОКИ
2.1 Урок: "Водород, способы получения, физические свойства"; Цель:изучение физических свойств, способов получения, распространение и применение водорода. Задачи: Образовательная – экспериментально получить и доказать свойства водорода. Развивающая – развивать умения выделять главное, обобщать, классифицировать при работе с учебной и научной литературой. Воспитательная – научить самостоятельно оценивать, наблюдать явления, развивать познавательный интерес к предмету. Тип урока: урок усвоения новых знаний, с элементами лабораторно-практических учебных задач. Методы: эвристическая беседа, поисковая деятельность, проблемные вопросы. Оборудование и реактивы: аппарат Киппа, гранулы цинка, раствор соляной кислоты, спички, штатив, пробирки, резиновая пробка. Подготовка к уроку: 1. Оформление доски. 2. Опережающие задания по темам: · История открытия водорода · Распространение и значение водорода · Историческое значение водорода 3. Схема «Распространение и применение водорода» (см. приложение №1) 4. Алгоритм выполнение опыта (см. приложение №2) 2.1.1 Целеполагания и мотивации Учитель: Сегодня мы с вами начнём урок нетрадиционно. Посмотрите, на доске отсутствует запись темы урока. И это не случайно, так как тему урока вы, дети, назовете сами. А поможет вам сделать это сообщение одноклассника. Первое сообщение: «История открытия водорода». Странным на первый взгляд делом занялся однажды английский учёный Кавендиш: он стал пускать мыльные пузыри. Но это было не развлечение. Перед этим Кавендиш заметил, что, когда железные опилки обливают серной кислотой, появляется много пузырьков какого-то газа. Что это за газ? Учёный вывел его по трубочкам из сосуда. Газ был невидим. Имеет ли он запах? Нет. Тогда Кавендиш наполнил им мыльные пузыри, и они легко поднялись вверх! А если поджечь газ? Он загорался голубоватым пламенем, но что удивительно – при горении получалась вода! Кавендиш назвал новый газ горючим воздухом. Ведь он, как и обычный воздух, был без цвета и запаха. Всё это происходило во второй половине 18-ого века. А позже французский химик Лавуазье сделал обратное: получил «горючий газ» из воды. Он же дал новому газу и другое имя – гидрогениум, т.е. водород или «рождающий воду». Учитель: Как вы думаете, какова тема нашего урока? Ученик: Водород. Учитель: Верно. На сегодняшнем уроке мы изучим способы получения, применения и физические свойства водорода. Откройте Периодическую систему химических элементов Дмитрия Ивановича Менделеева, найдите в ней водород. – Какой порядковый номер имеет водород? – Какое место он занимает? – Как вы думаете, почему именно водород занимает первое место в таблице химических элементов? (учащиеся высказывают свои предположения) Водород не случайно занимает такое почётное место в системе. Он обладает уникальными физическими и химическими свойствами, что обеспечивает ему право называться элементом № 1. А почему он получил это право, вы узнаете, прослушав ещё одно сообщение. На ваших столах лежат карточки с незаполненной схемой. Ваша задача: по ходу доклада заполнить ее, указав область распространения и применения водорода. Второе сообщение: «Распространение и значение водорода». Водород – самый распространённый элемент вселенной. Он входит в состав всех живых существ, растений, горных пород. Он есть везде: не только на Земле, но и на других планетах и звёздах. Наше Солнце, по меньшей мере, на половину состоит из водорода. Всего на Солнце было обнаружено 69 химических элементов, но водород преобладает. Особенно много его в космическом пространстве. Превращения, которые происходят с водородом при гигантском давлении и температуре в десятки миллионов градусов дают возможность Солнцу излучать тепло и свет. Больше всего различных соединений образует водород с углеродом: нефть и горючие сланцы, бензин и черный асфальт. Такие соединения называются углеводородами. Водород широко применяется при сварке и резке металлов. Если к соединениям углерода и водорода добавить кислород, получаются новые соединения – углеводы, такие как крахмал и сахар. А если водород соединить с азотом получится тоже газ – аммиак. Он необходим для изготовления удобрений. Учитель: Пользуясь вашими схемами, назовите область распространения и применения водорода? Ученик: – нефть, бензин; – космическое пространство; – солнце; – сварка и резка металлов; – крахмал, сахар; – аммиак, удобрения. Учитель: Молодцы! Мы рассмотрели применение водорода в наше время, но водород был открыт еще в 18-ом веке и уже тогда он находил практическое значение. Давайте узнаем, где же он применялся. Третье сообщение: «Историческое значение водорода». Водород легче воздуха в 14.5 раз, поэтому он нашёл широкое применение в воздухоплавании. Первыми, кто осуществил идею подняться на аппарате легче воздуха, были братья французы Монгольфье в 1783 году. Их воздушный шар был наполнен горячим воздухом. Однако такой шар после охлаждения терял свою подъёмную силу. В этом же году совершил полёт на воздушном шаре, наполненном водороде французский физик Шарль. Уже в 1794 году воздушные шары нашли практическое применение в воздушном деле. В битве французская армия одержала победу над австрийским войском благодаря искусным применениям дирижабля, наполненным водородом. Поднявшись на недосягаемою высоту для неприятельского огня французы в течение всей битвы наблюдали за передвижением противника. Русский химик Менделеев воспользовался воздушным шаром для наблюдения солнечного затмения. Однако применение водорода в воздухоплавании было слишком опасно, т.к. воспламенение водорода приводило к гибели аппарата. 2.1.2 Постановка учебной задачи и её решение через эксперимент. Учитель: Как вы думаете, почему применение водорода было и остаётся опасным? Чтобы ответить на этот вопрос нужно знать свойства водорода, а для этого нам надо его получить. В лаборатории водород в больших количествах получают с помощью аппарата Киппа (рисунок в учебнике). Он состоит из двух частей: верхняя шарообразная воронка и нижняя часть, разделённая перетяжкой на два сосуда. В среднюю часть помещают твёрдое вещество(Zn), а в верхнюю воронку наливают жидкость(HCl). Нижняя часть служит для сливания отработанной жидкости. Нам с вами столько водорода не нужно, поэтому вы получите его сами в гораздо меньшем количестве. У вас на столах находятся необходимые реактивы и оборудование, там же находятся карточки с алгоритмом выполнения работы, чётко следуйте инструкции, только в том случае у вас получится опыт. Не забывайте о соблюдении правил техники безопасности. Приступайте к выполнению (учащиеся выполняют лабораторный опыт). Дети, сколько хлопков вы услышали? Чем, отличается первый хлопок от второго? Как вы думаете, почему? (учащиеся высказывают предполагаемые ответы). Первый раз в пробирке находился воздух, а в состав воздуха входит кислород. При получении водорода эти газы смешиваются, и образуется гремучий газ, состоящий из двух объёмов водорода и одного объёма кислорода. В момент опускания горящей спички кислород сгорает, его становится меньше, соотношение газов изменяется, второй хлопок становится тише. А почему вылетали пробки? Ученик: Потому что водород легче воздуха в 14.5 раз. Учитель: Теперь вы можете ответить, почему применение водорода опасно? Ученик: Так как при смешивании его с кислородом образуется взрывоопасная гремучая смесь. Учитель: Назовите свойства водорода, которые вы рассмотрели в ходе эксперимента (ученики называют свойства водорода для записи в тетрадь). Ученик: Газ, без вкуса, цвета и запаха, легче воздуха. Учитель: Однако в наше время в воздухоплавании используют воздушные шары для метеорологических исследований, но наполняют не чистым водородом, а смесью водорода и гелия. Ярким примером являются воздушные шары, которые запускают во время праздничных церемоний. 2.1.3 Практическая работа с учебником, поиск заданной информации Мы рассмотрели получение водорода в лаборатории, теперь разберем, как получают водород в промышленности. Работая в парах, используя материал учебника на страницах 118 и 80, определите пять промышленных способов получения водорода, выпишете уравнения химических реакций. Учитель открывает доску с готовыми уравнениями. Учащиеся сверяют свои записи.
1. TiH2 2. CH4 + 2H2O 3. 2H2O 4. CH4
5. Разложение воздуха N2, O2, H2 2.1.4 Рефлексия Подумайте и закончите предложения: – Сегодня на уроке я узнал… – На уроке я понял… – Теперь я знаю как… 2.1.5 Оценивание работы учащихся 2.1.6 Домашнее задание § 6.5. Решить задачу: Вычислить объём водорода, который я получил сегодня на уроке, если у меня было 1 г цинка. 2.2 Урок — практическая работа "Получение водорода и его свойства";
Задачи Образовательные: закрепить на практике знание признаков химических реакций; продолжить формирование умения записывать уравнения реакций и определять их тип. Развивающие: продолжать формировать умения - наблюдать, описывать химические реакции, делать выводы, обращаться с лабораторным оборудованием. Воспитывающие: продолжать формировать умение - работать в парах, помогать друг другу, а также культуру поведения на уроках-практикумах. Здоровьесберегающие: мотивировать учащихся на ЗОЖ, соблюдая правила техники безопасности на уроке при проведении эксперимента; добиваться оптимальной работоспособности в течение всего урока, за счет смены видов деятельности; создавать благоприятный психологический климат на уроке.
|

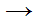 Ti + H2
Ti + H2