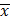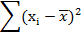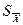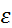Комплексонометрическое определение
Ход работы:
1. Приготовление стандартных MgSO4*7H2O и ZnSO4 (C=0,02 моль/л методом точной навески) 2. Приготовление раствора титранта ЭДТА (трилона Б) (С=0,02 моль/л методом приблизительной концентрации). 3. Стандартизация раствора титранта ЭДТА (основана на реакциях комплексообразования). Реакции: а) Mg2+ + HJnd2- + OH- →
б)
Методика: в 3 колбы для титрования берут аликвоты MgSO4 (по 5 мл), добавляют по 10 мл аммиачного буферного раствора (для создания среды), добавляют по 0,1 г порошка индикатора эриохрома чёрного Т, тщательно перемешивают. Пипетку на 10 мл заполняют раствором титранта ЭДТА и титруют содержимое колб по очереди до перехода окраски из вишнёво-красной в синюю (цвет свободного индикатора). Определяют средний объём титранта и рассчитывают его концентрацию.
С(ЭДТА)=
V1(ЭДТА)=5,2; V3(ЭДТА)=5,2;
С(ЭДТА)=
4. Определение W% CuSO4*5H2O. Определение проводят методом обратного титрования. Реакции: а) Cu2+ + б) в) Zn2+ +
Методика: навеску препарата растворяют в дист.воде в мерной колбе на 50 мл. в 3 колбы для титрования берут аликвоты (по 2 мл) полученного раствора, добавляют точно измеренный избыточный объём титранта ЭДТА (по 6 мл), нагревают для ускорения реакции. Затем к охлаждённому р-ру добавляют аммиачный буферный раствор (6 мл) и индикатор эриохром чёрный Т, тщательно перемешивают. Затем избыточное количество титранта ЭДТА оттитровывают с помощью стандартизированного р-ра ZnSO4. Точку конца титрования фиксируют по переходу окраски из синей в вишнёво-красную. Из каждого результата рассчитывают m в-ва CuSO4, данные усредняют и рассчитывают W% по формуле:
W%=
mв-ва =
Затем проводят статистическую обработку данных. (пояснения к обозначениям см.выше)
|

 + H2O;
+ H2O; + H2Y2- + OH- →
+ H2Y2- + OH- →  +
+  + H2O.
+ H2O. , моль/л
, моль/л
 0,01912 моль/л
0,01912 моль/л + 2OH- →
+ 2OH- →  + 2H2O;
+ 2H2O;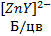 + 2H2O;
+ 2H2O; + H2O;
+ H2O;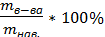 , а
, а *
*  ,г
,г ср
ср