Йодометрическое титрование
|
Фланец
Это – соединительная часть труб, резервуаров, валов и т.д. как правило, представляющая собой плоское стальное кольцо или диск, в которых имеются отверстия под болты или шпильки.
Сфера применения
Для соединения изделий арматуры с трубопроводами, соединения отдельных участков трубопроводов между собой и для присоединения трубопроводов к различному оборудованию.
Фланцевое соединение обеспечивает герметичность и прочность конструкций, а также простоту изготовления, разборки и сборки.
Задать вопрос касаемо поставки или проконсультироваться у специалистов ПКФ Промстандарт можно по телефонам: +7 (8202) 57-03-41, 604-666

КАФЕДРА ХИМИИ
УИРС
Тема:
«Количественное определение массовой доли (W%)
меди сульфата»
Выполнила: Студентка 2 курса ФФ гр. 3802
Селюнина А.В.
Проверил:
Белоусова Н.И.
Томск 2010
Фармакопейная характеристика препарата
Cupri sulfas
Меди сульфат
Cuprum sulfuricum
CuSO4*5H2O Мол.масса=249,68 г/моль
Описание:
Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. Медленно выветривается на воздухе. Водные растворы имеют слабокислую реакцию.
Растворимость:
Легко растворим в воде, очень легко – в кипящей воде, практически нерастворим в 95%-ом спирте.
Подлинность:
ü Раствор препарата (1:20) при соприкосновении с железом покрывает его красным налётом металлической меди.
ü При добавлении по каплям к такому же количеству препарата раствора NH3 образуется голубой осадок, растворяющийся в избытке реагента. Полученный раствор имеет тёмно-синее окрашивание.
ü Препарат даёт характерную реакцию на сульфаты: к 2мл р-ра сульфата (0,005-0,05 г иона SO42-) прибавляют 0,5 мл разведённой соляной кислоты и 0,5 мл р-ра барий хлорида, образуется белый осадок, нерастворимый в разведённых кислотах.
Прозрачность раствора:
Раствор 0,5 препарата в 10 мл воды должен быть прозрачным.
Допустимые примеси:
Препарат должен содержать не более 0,2% солей металлов, не осождаемых сероводородом.
Хранение:
Список Б. в хорошо упакованной таре.
Высшая разовая доза:
Внутрь 0,5г (однократно как рвотное средство).
Применение:
ü CuSO4*5H2O (медный купорос) применяется наружно в виде 0,25% р-ра как антисептическое и вяжущее средство при коньюктивитах. Воспалительных процессах мочеполовой системы.
ü При ожогах кожи фосфором обильно смачивают обожжённый участок 5% р-ом.
ü Малые дозы (5-10 капель с молоком) применяют внутрь при анемии. Большие дозы вызывают рвоту.
Йодометрическое титрование
Ход работы:
1. Приготовление стандартного раствора K2Cr2O7 (Cfэкв=0,02 моль/л, методом точной навески)
2. Приготовление раствора титранта Na2S2O3*5H2O (Cfэкв=0.02 моль/л, методом приблизительной концентрации).
3. Стандартизация раствора титранта Na2S2O3*5H20 (методом замещения)
Реакции:
а) K2Cr2O7 + 6KJ + 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O
б) J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Методика: в 3 колбы для титрования берут аликвоты K2Cr2O7 (по 5 мл), добавляют 10мл KJ (W=5%), по 2 мл р-ра H2SO4 (2 моль/л). Колбы закрывают часовым стеклом. Оставляют в темноте на 5-10 мин. Выделившийся в результате реакции йод оттитровывают р-ом титранта Na2S2O3 из пипетки на 10мл до соломенно-жёлтого цвета, затем добавляют крахмал и титруют до исчезновения синей окраски. Определяют средний объём титранта и рассчитывают его концентрацию эквивалента.
С(Na2S2O3)= 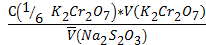 , моль/л
, моль/л
V1(Na2S2O3)=6,1;
V2(Na2S2O3)=6,3; 
V3(Na2S2O3)=6,2;
С(Na2S2O3)=  = 0,0161 моль/л
= 0,0161 моль/л
4. Определение W% CuSO4*5H2O (фармакопейная методика).
Определение проводят методом замещения.
Реакции:
а) 2CuSO4 + 4KJ 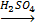 2CuJ2 + J2 + 2K2SO4
2CuJ2 + J2 + 2K2SO4
б) J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Методика: навеску препарата растворяют в 5мл дист.воды, прибавляют 0,4 мл разбавленной H2SO4, 0,3г сухого KJ; выделившийся в реакции йод титруют р-ром Na2S2O3, фиксируя конец титрования с помощью крахмала. титрование ведут 5 раз. Из каждого результата рассчитывают W% CuSO4 по формуле:
W%= 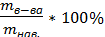 , а mв-ва =
, а mв-ва = 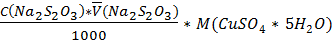 .
.
1. m(нав)1=0,101г; m(в-ва)1 = 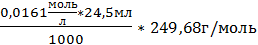 =0,09848
=0,09848
V(Na2S2O3)1= 24,5мл; W%1= 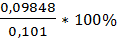 = 97,5%
= 97,5%
2. m(нав)2=0,099г; m(в-ва)2 =  =0,09768
=0,09768
V(Na2S2O3)2= 24,3мл; W%2=  = 98,6%
= 98,6%
3. m(нав)3=0,096г; m(в-ва)3 = 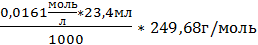 =0,09406
=0,09406
V(Na2S2O3)3= 23,4мл; W%3= 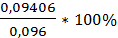 = 97,9%
= 97,9%
4. m(нав)4=0,098г; m(в-ва)4 = 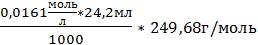 =0,09728
=0,09728
V(Na2S2O3)4= 24,2мл; W%4= 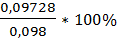 = 99,2%
= 99,2%
5. m(нав)5=0,104г; m(в-ва)5= 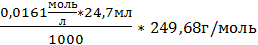 =0,09929
=0,09929
V(Na2S2O3)5= 24,7мл; W%5= 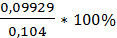 = 95,4%
= 95,4%
Затем проводят статистическую обработку данных.
n – число измерений;
Xi – результат единичного измерения;
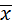 – результат среднего значения измеренной величины;
– результат среднего значения измеренной величины;
 – разность значения единичного и среднего измерений;
– разность значения единичного и среднего измерений;
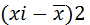 – квадрат разности;
– квадрат разности;
 – стандартное отклонение единичного измерения;
– стандартное отклонение единичного измерения;
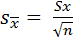 или
или 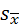 =
= 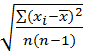 - стандартное отклонение
- стандартное отклонение 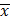 ;
;
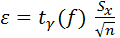 – границы доверительного интервала,
– границы доверительного интервала, 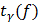 – коэф-т Стьюдента.
– коэф-т Стьюдента.
X ± 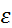 – результат анализа.
– результат анализа.
| Хi (W%) | n | 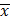
| xi- 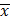
| (xi- 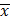 )2 )2
| 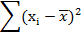
| Sx | 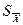
| 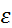
| X ± 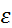
|
| 97,5 | 97,72 | -0,22 | 0,0484 | 8,428 | 1,451 | 0,649 | 1,79 | 97,72±1,79 | |
| 98,6 | 0,88 | 0,7744 | |||||||
| 97,9 | 0,18 | 0,0324 | |||||||
| 99,2 | 1,48 | 2,1904 | |||||||
| 95,4 | -2,32 | 5,3824 |




