Фотоколориметрическое определение
Ход работы:
1. Построение калибровочного графика Для построения графика необходима серия растворов определяемого вещества с различными концентрациями. Для приготовления исходного раствора взвешивают на аналитических весах 1,9635г химически чистой соли CuSO4*5H2O. Навеску переносят в мерную колбу на 500мл. растворяют в небольшом количестве дистиллированной воды, затем добавляют 200мл H2SO4 (2 моль/л) и доводят объём дистиллированной водой до метки. Раствор аммиака готовят разбавлением 15мл конц.р-ра NH3 до объёма 200 мл дистиллированной водой. Растворы для построения графика готовят следующим образом: берут 5 мерных колб (на 50 мл), в каждую помещают точное количество исходного раствора (2,4,6,8,10 мл) и добавляют по 20 мл р-ра NH3 (водн.) и воды до метки. содержимое колб перемешивают. Затем измеряют оптическую плотность каждого раствора и на основании полученных результатов строят график зависимости Д=f(C), (С моль/л). Концентрацию вещества в колбе на 500 мл можно найти по формуле:
С=
2. Определение содержания меди (II) в р-ре неизвестной концентрации.
Методика: раствор соли CuSO4*5H2O готовят следующим образом. Навеску препарата растворяют в 5мл дистиллированной воды в колбе на 50мл, добавляют 20мл р-ра NH3(водн.) и воды до метки. Затем измеряют оптическую плотность полученного р-ра и по графику находят его концентрацию. Затем проводят расчет массы вещества и массовой доли его в навеске по формулам:
mв-ва= C*V*M, где V=0,05л, M=249,68 г/моль; mв-ва = 0,0017моль/л*0,05л*249,68г/моль = 0,02122 г
W%=
Оптическая плотность:
Вывод: Таки образом, мы провели определение массовой доли вещества в препарате тремя методами и получили следующие денные: Йодометрия - 97,72±1,79 %; Комплексонометрия - 96,6±2,21%; Фотоколориметрия - 96,46%; Можно сделать вывод, что Йодометрия из 3х предложенных способов является более точной, следом по убывающей идёт комплесонометрия, а затем фотоколориметрия.
|

 =
=  = 0,0157 моль/л.
= 0,0157 моль/л.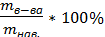 , где mнав=0,022г; W%=
, где mнав=0,022г; W%=  = 96,46%
= 96,46%



