Процесс окисления происходит при движении электронов по дыхательной цепи от субстратов тканевого дыхания на кислород. Дыхательная цепь окислительного фосфорилирования состоит из 4 белковых комплексов, встроенных во внутреннюю мембрану митохондрий и небольших подвижных молекул убихинона и цитохрома С, которые циркулируют в липидном слое мембраны между белковыми комплексами.
 Комплекс I – НАДН2 дегидрогеназный комплекс –
Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe
2S
2 и Fe
4S
4) белков.
Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок.
Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b
562, b
566, с
1, и железо-серный белок.
Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а
3) и 2 атома меди.
Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q
10). Убихинон переносит по 2Н
+ и 2е
-.
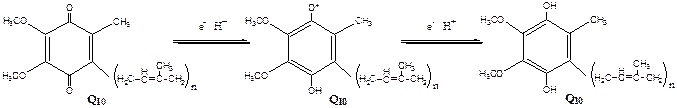
убихинон ↔ семихинон ↔ гидрохинон
Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН
2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c
1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона.
Электрохимический потенциал. Компоненты дыхательной цепи располагаются в мембране в порядке повышения их редокс-потенциала. При переходе е
- от комплекса с низким редокс-потенциалом к комплексу с более высоким редокс-потенциалом происходит выделение свободной энергии. При окислении 1 НАДН
2 выделяется 220 кДж/моль свободной энергии.I, III и IV комплексы дыхательной цепи используют 65-70% этой свободной энергии для переноса Н
+ из матрикса митохондрий в межмембранное пространство, 30-35% свободной энергии рассеивается в виде тепла.
 Этапы движения е- по дыхательной цепи
Этапы движения е- по дыхательной цепи 1. 2е
- от НАДН
2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н
+ (механизм переноса Н
+ неизвестен).2. КоQ с 2е
- забирает у воды 2Н
+ из матрикса и превращается в КоQН
2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН
2 переносит 2е
- на комплекс III, а 2Н
+ в межмембранное пространство.4. Цитохром С переносит е
- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е
- на О
2, высвобождаемая при этом энергия обеспечивает перекачку Н
+ (механизм переноса Н
+ неизвестен). При переносе Н
+ из матрикса в межмембранное пространство на внутренней мембране создается
осмотический градиент протонов ∆рН = 60 мВ (при ∆рН=1) (в матриксе рН выше, чем в цитозоле). Так как каждый Н
+ несет положительный заряд, на внутренней мембране также появляется
разность потенциалов ∆V=160мВ, внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В сумме осмотический градиент протонов и разность потенциалов образуют
электрохимический потенциал, который в типичной клетке составляет около 60+160=220 мВ. Механизм переноса Н
+ через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е
- с перемещением Н
+. Образовавшийся на внутренней мембране митохондрий электрохимический потенциал используется для:1) фосфорилирования АДФ в АТФ; 2) транспорта веществ через мембрану митохондрий; 3) теплопродукцию.
Процесс фосфорилирования Процесс фосфорилирования осуществляется АТФ-синтетазой (Н
+-АТФ-аза), которая потребляет 40-45% свободной энергии, выделившейся при окислении. Н
+-АТФ-аза интегральный белок внутренней мембраны митохондрий, она состоит из 2 белковых комплексов F
0 и F
1.

 | Гидрофобный комплекс F0 погружён в мембрану и служит основанием, которое фиксирует АТФ-синтазу в мембране. Он состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, γ, δ, ε). Субъединицы α и β уложены попарно, образуя «головку»; между а- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ, δ, ε – субъединицы связывают комплекс F1, с F0. |

АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей.Электрохимический потенциал внутренней мембраны заставляет Н
+ двигаться из межмебранного пространства по каналу АТФ-синтазы в матрикс митохондрий. При каждом переносе протонов через канал F
o энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла: 1) связывание АДФ и Н
3РО
4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ.
 Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок. Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок. Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди. Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-.
Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок. Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок. Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди. Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-. 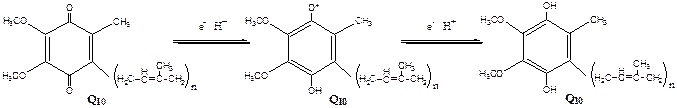 убихинон ↔ семихинон ↔ гидрохинон Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона. Электрохимический потенциал. Компоненты дыхательной цепи располагаются в мембране в порядке повышения их редокс-потенциала. При переходе е- от комплекса с низким редокс-потенциалом к комплексу с более высоким редокс-потенциалом происходит выделение свободной энергии. При окислении 1 НАДН2 выделяется 220 кДж/моль свободной энергии.I, III и IV комплексы дыхательной цепи используют 65-70% этой свободной энергии для переноса Н+ из матрикса митохондрий в межмембранное пространство, 30-35% свободной энергии рассеивается в виде тепла.
убихинон ↔ семихинон ↔ гидрохинон Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона. Электрохимический потенциал. Компоненты дыхательной цепи располагаются в мембране в порядке повышения их редокс-потенциала. При переходе е- от комплекса с низким редокс-потенциалом к комплексу с более высоким редокс-потенциалом происходит выделение свободной энергии. При окислении 1 НАДН2 выделяется 220 кДж/моль свободной энергии.I, III и IV комплексы дыхательной цепи используют 65-70% этой свободной энергии для переноса Н+ из матрикса митохондрий в межмембранное пространство, 30-35% свободной энергии рассеивается в виде тепла.  Этапы движения е- по дыхательной цепи 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает у воды 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен). При переносе Н+ из матрикса в межмембранное пространство на внутренней мембране создается осмотический градиент протонов ∆рН = 60 мВ (при ∆рН=1) (в матриксе рН выше, чем в цитозоле). Так как каждый Н+ несет положительный заряд, на внутренней мембране также появляется разность потенциалов ∆V=160мВ, внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В сумме осмотический градиент протонов и разность потенциалов образуют электрохимический потенциал, который в типичной клетке составляет около 60+160=220 мВ. Механизм переноса Н+ через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Образовавшийся на внутренней мембране митохондрий электрохимический потенциал используется для:1) фосфорилирования АДФ в АТФ; 2) транспорта веществ через мембрану митохондрий; 3) теплопродукцию. Процесс фосфорилирования Процесс фосфорилирования осуществляется АТФ-синтетазой (Н+-АТФ-аза), которая потребляет 40-45% свободной энергии, выделившейся при окислении. Н+-АТФ-аза интегральный белок внутренней мембраны митохондрий, она состоит из 2 белковых комплексов F0 и F1.
Этапы движения е- по дыхательной цепи 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает у воды 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен). При переносе Н+ из матрикса в межмембранное пространство на внутренней мембране создается осмотический градиент протонов ∆рН = 60 мВ (при ∆рН=1) (в матриксе рН выше, чем в цитозоле). Так как каждый Н+ несет положительный заряд, на внутренней мембране также появляется разность потенциалов ∆V=160мВ, внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В сумме осмотический градиент протонов и разность потенциалов образуют электрохимический потенциал, который в типичной клетке составляет около 60+160=220 мВ. Механизм переноса Н+ через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Образовавшийся на внутренней мембране митохондрий электрохимический потенциал используется для:1) фосфорилирования АДФ в АТФ; 2) транспорта веществ через мембрану митохондрий; 3) теплопродукцию. Процесс фосфорилирования Процесс фосфорилирования осуществляется АТФ-синтетазой (Н+-АТФ-аза), которая потребляет 40-45% свободной энергии, выделившейся при окислении. Н+-АТФ-аза интегральный белок внутренней мембраны митохондрий, она состоит из 2 белковых комплексов F0 и F1. 
 АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей.Электрохимический потенциал внутренней мембраны заставляет Н+ двигаться из межмебранного пространства по каналу АТФ-синтазы в матрикс митохондрий. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла: 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ.
АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей.Электрохимический потенциал внутренней мембраны заставляет Н+ двигаться из межмебранного пространства по каналу АТФ-синтазы в матрикс митохондрий. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла: 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ.




