Энергия Гиббса и состояние химического равновесия. энтропийно выгодным будет процесс распада АВ(г) на компоненты (∆S>0), а энергетически выгодным является обратный процесс
Для реакции АВ(г) «А(г)+ В(г) энтропийно выгодным будет процесс распада АВ(г) на компоненты (∆S >0), а энергетически выгодным является обратный процесс, который сопровождается понижением энтальпии химической системы (∆H <0), т.е. выделением теплоты. На каждую из этих противоположных тенденций влияют и природа веществ, и условия проведения реакции. Учитывает эти противоположные тенденции предложенная американским физико-химиком Д. Гиббсом функция состояния, которая называется энергией Гиббса: G = H − TS, (3.14) ∆G=∆H − T∆S. (3.15) Произведение энтропии и температуры (T∆S) определяет величину “связанной” энергии, т.е. ту часть энергии (энтальпии) системы, которую невозможно перевести в работу. Разница между «энергосодержанием» системы (Н) и «связанной» энергией дает долю энергии, которую можно в принципе перевести в работу. Энергия Гиббса определяет работоспособность системы. При обратимом и изотермическом проведении процесса DG равно по абсолютной величине, но обратно по знаку максимально полезной работе (А max), которую система может произвести в данном процессе: ∆G р=− А max. Энергия Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно-изотермических процессах. Химическая реакция принципиально возможна, если энергия Гиббса уменьшается, т.е. ∆Gр <0. Знак ∆G указывает на направление реакции. При ∆G <0 реакция протекает в прямом направлении. При ∆G>;0 возможен лишь обратный процесс. При ∆G= 0 все вещества находятся в химическом равновесии и внешне незаметно никаких изменений и процессов в системе. Из уравнения ∆G = ∆H − T∆S следует: 1) если ∆H <0 и ∆S >0, то всегда ∆G <0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любых температурах; 2) если ∆H>;0 и ∆S <0, то всегда ∆G >0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях; 3) во всех остальных случаях (∆H <0, ∆S <0 и ∆H >0, ∆S >0) знак ∆G зависит от соотношения членов ∆H и T∆S. Значения ∆H и ∆S могут быть как положительными, так и отрицательными в разных сочетаниях в разных реакциях. Их рассматривают как энергетический (энтальпийный) и энтропийный факторы, определяющие возможность самопроизвольного протекания реакции. Реакция возможна, только если она сопровождается уменьшением энергии Гиббса. Если ∆H <0, ∆S <0; в этом случае ∆G < 0 при Если ∆H >0, ∆S >0, то произведение T∆S будет больше, чем ∆H и определяющим фактором будет знак ∆S. В этом случае ∆G <0 при 4) при равенстве ∆; G =0 в системе устанавливается химическое равновесие, которое может смещаться в любую сторону при изменении внешних факторов (температура, давление, концентрации реагирующих веществ). Энергия Гиббса образования вещества. Величина энергии Гиббса вещества зависит как от природы этого вещества, так и от его количества: G A=(G oA+ RT ln p A) n A, (3.16) где G A− энергия Гиббса образования вещества А при его парциальном давлении р А (p А¹1атм ); G oA− энергия Гиббса образования одного моля вещества А при стандартных условиях (р А=1 атм и Т =298 К); n A − число молей вещества А. Стандартная энергия Гиббса образования вещества DGо298 − изменение энергии Гиббса в реакции образования 1моль вещества из простых веществ, находящихся в устойчивых состояниях при стандартных условиях (р =101,3 кПа и Т =298 К). Значения ∆G о298 для некоторых веществ приводятся в справочной литературе, размерность − кДж/моль. Стандартные энергии Гиббса образования простых веществ, находящихся в стандартном состоянии в устойчивой модификации, равны нулю. Например, ∆G о298,Н2(газ) = 0 кДж/моль. Энергия Гиббса химических реакций. Изменение энергии Гиббса химической реакции при стандартных условиях (р =101,3 кПа и Т =298 К) можно вычислить по уравнению ∆G о298, реакции = ∆H о 298, реакции – T∆S о298, реакции, (3.17) где ∆H о298,реакции, ∆S о298,реакции − стандартные изменения энтальпии и энтропии химической реакции, соответственно в кДж и Дж/К; Т − стандартная температура, равная 298 К. Поскольку энергия Гиббса является функцией состояния, то ее значение не зависит от пути протекания процесса, а зависит только от исходного и конечного состояний системы. Изменение энергии Гиббса при стандартных условиях (∆G о298, реакции) можно рассчитать, используя стандартные значения энергий Гиббса образования исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов: ∆G о298,реакции = Изменение энергии Гиббса ∆G Т для реакции, протекающей при температуре, отличной от стандартной (Т ∆G Т = ∆H ореакции – T∆;Sореакции. (3.19)
|

 , т.е. реакция возможна при сравнительно низкой температуре. При низких температурах значение Т невелико, значит, величина произведения T∆S также невелика, и обычно абсолютное значение ∆H превосходит абсолютное значение T∆S. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком ∆H.
, т.е. реакция возможна при сравнительно низкой температуре. При низких температурах значение Т невелико, значит, величина произведения T∆S также невелика, и обычно абсолютное значение ∆H превосходит абсолютное значение T∆S. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком ∆H.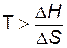 , т.е. процесс возможен при сравнительно высокой температуре;
, т.е. процесс возможен при сравнительно высокой температуре; ∆G о298, продукты реакции –
∆G о298, продукты реакции –  298 К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (∆H ореакции) и энтропии (∆S ореакции ) реакции и пренебрегая их зависимостью от температуры:
298 К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (∆H ореакции) и энтропии (∆S ореакции ) реакции и пренебрегая их зависимостью от температуры:


