Гетерофазное алкилирование бензола пропиленом».
1. Горение:
CnH2n + 3n/2O2 t, p, kat →;nCO2 + nH2O + Q (пламя ярко светящее)
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– этокачественная реакция алкенов, розовый раствор марганцовки обесцвечивается. R-CH=CH2 + KMnO4 + H2O → R-CH-CH2 + MnO2↓ + KOH │ │; OH OH
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2-CH2 + 2MnO2↓ + 2KOH │ │ OH OH (этиленгликоль)
Влияние среды на характер продуктов реакций окисления 1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2): а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O б) 5CH3 – C = CH – CH3+6KMnO4+9H2SO4 → 5CH3 – C – CH3+5CH3COOH+6MnSO4+3K2SO4+9H2O │ ║ CH3 O 2-метилпропен ацетон в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O 2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше)
Гетерофазное алкилирование бензола пропиленом».
Выполнил: ст.гр. ХТ-07-4 Кускильдина Ю.Р. Проверил: Толстых Л.И.
Москва 2011 Введение.
Изопропилбензол является одним из самых крупнотоннажных производств промышленности нефтехимического синтеза. Он использовался самостоятельно в качестве высокооктановой добавки к бензинам, в качестве сырья для производства a-метилстирола – мономера при производстве бутадиена - a-метилстирольных каучуков, либо использовали его для производство фенола (и совместно с ним – ацетона) – важнейшего сырья для производства синтетических смол и присадок к маслам и топливам. Изопропилбензол (тривиальное название – кумол) – это жидкость с температурой кипения 152,4 оС при атмосферном давлении, плотностью r420=0.86179 и показателем преломления nD 20=1,49145. Общую схему реакции можно представить как последовательное присоединение молекул пропилена к бензолу:
Процесс алкилирования бензола пропиленом является каталитическим процессом. В качестве катализаторов алкилирования используются бренстедовские кислоты (преимущественно – форсфорные), кислоты Льюиса (как правило – хлорид алюминия) и цеолиты. В историческом плане первое промышленное оформление алкилирования бензола пропиленом базировалось на работах академика Ипатьева, предложившего в качестве катализатора фосфорные кислоты. В этом случае процесс протекает в паро-жидкостной системе при достаточно высокой температуре и давлении с получением кумола не очень высокого качества из-за присутствия в нем непредельных соединений:
Одновременно протекает реакция олигомеризации пропилена:
В этом случае в реакционной массе алкилирования присутствуют одновременно как кумол так и олигомеры пропилена, в том числе нонены (тримеры пропилена), При дальнейшей обработке реакционной массы (при ректификации) димеры и тетрамеры пропилена легко отделяются от изопропилбензола, так как температуры их кипения сильно отличаются от таковой ИПБ. Однако тримеры пропилена (нонены) по температуре кипения близки к ИПБ, и часть олефинов попадает в целевой изопропилбензол. Если этот кумол далее предполагается использовать в качестве добавки к топливу или для производства a-метилстирола, то никаких проблем не возникает. Если же этот кумол предполагают использовать в качестве сырья для производства фенола, то необходимо освободиться от олефинов, например, гидрированием, так как олефины являются ингибиторами окисления. Такой путь решения проблемы был выбран в США, где вторичные процессы гидрирования, как и другие методы вторичные методы переработки нефти широко развиты. В Европе и, в частности, в России развилось другое направление – производство кумола с использованием в качестве катализатора безводного хлорида алюминия. Обычный хлорид алюминия Al[H2O]6Cl3 представляет собой гексааквакомплекс, который каталитически совершенно не активен. Для придания ему каталитической активности гексааквакомплекс превращают в безводный хлорид алюминия методом возгонки (очень энергоемкий процесс, существенно увеличивающий себестоимость продукта). Однако безводный хлорид алюминия в углеводородных средах не растворяется и каталитической активности не проявляет. В то же время в присутствии HCl или галогенидов углеводородов (RCl) хлорид алюминия совместно с растворителем, желательно, с ароматическими углеводородами, превращается в комплекс, называемым комплексом Гувставсона, который и проявляет искомую каталитическую активность. Комплекс представляет собой соединение AlCl3 и HCl c 1 – 6 молекулами ароматического углеводорода, одна из которых находится в особом структурном состоянии положительно заряженного иона (s-комплекс), а остальные образуют сольватную оболочку. Комплекс Густавсона представляет собой густую достаточно вязкую жидкость плотностью выше, чем плотность дисперсной среды, в которой он образовался. Растворимость комплекса при температуре, при которой обычно проводится гетерофазное алкилирование, т.е. при температуре 100 –130 о С, ограничена и система расслаивается. Комплекс Густавсона катализирует не только алкилирование бензола, но и олигомеризацию пропилена (как и фосфорная кислота). Разница между этими катализаторами заключается в том, комплекс густавсона является гораздо более сильным катализатором олигомеризации по сравнению с фосфорной кислотой. Известно, например, что из пропилена в присутствии хлорида алюминия (и особенно бромида алюминия) при низких температурах получаются высоковязкие продукты наподобие синтетически масел. Благодаря очень высокой олигомеризующей способности комплекса Густавсона в реакционной массе алкилирования практически не наблюдается присутствия низкомолекулярных олигомеров, в том числе и тримеров, а поэтому при ректификации целевой изопропилбензол не загрязняется олефинами; поэтому такой кумол может быть использован в качестве сырья для производства фенола и ацетона окислительным методом.
Термодинамика процесса.
Реакции алкилирования благоприятны низкие температуры вследствие экзотермичности этой реакции, но ее термодинамическая вероятность значительна даже при высоких температурах (800 К). При 300 – 600 К алкилирование можно осуществить с практически полным израсходованием одного из реагентов. Проведение реакции в жидкой фазе термодинамически более благоприятно, чем в газовой, но это несущественно; в обоих случаях возможна конверсия выше 99 %. Поэтому реакцию можно рассматривать как необратимую.
Механизм и кинетика процесса.
Алкилирование в присутствии комплекса Густавсона протекает очень быстро, сильно ускоряется при механическом перемешивании или интенсивном барботаже олефина через реакционную массу. Реакция протекает в диффузионной или близкой к ней области. Комплекс Густавсона при обычных температурах алкилирования (до 100 –130 оС) плохо растворяется в реакционной массе, поэтому реакция протекает в гетерогенной системе. Пропилен, растворенный в реакционной массе (растворимость пропилена зависит от давления) диффундирует к частицам дисперсной фазы (комплекс Густавсона), преодолевает пограничный слой и реагирует внутри комплекса. То же самое имеет место и бензолом. Образовавшийся продукт диффундирует в обратном направлении. Таким образом, реакционная масса и комплекс Густавсона непрерывно обмениваются лигандами. С увеличением дисперсности дисперсной фазы (комплекса) увеличивается поверхность взаимообмена (влияние перемешивания или барботажа) и скорость реакции повышается. В общем виде механизм алкилирования можно представить схемой:
Реакция протекает с образованием p- комплекса, который затем трансформируется в s-комплекс, общая схема превращений приводится ниже.
Целевым продуктом алкилирования является моноалкилбензол (кумол). Однако продукт алкилирования (кумол) легче алкилируется, чем исходный бензол, что приводит к образованию значительных количеств диизопропилбензолов. Поэтому диалкилбензолы возвращают назад в процесс (реакция переалкилирования):
Скорость алкилирования бензола мало зависит от температуры из-за низкой энергии активации. Скорость реакции переалкилирования значительно ускоряется с повышением температуры, так как энергия активации этой реакции существенно выше (63 кДж/моль). Обе реакции замедляются по мере дезактивации катализатора, но особенно сильно падает скорость переалкилирования. В результате в реакционной смеси будет накапливаться значительное количество полиалкилбензолов, не успевшее вступить в обратимую реакцию переалкилирования.
Технология процесса. (анализ работы алкилатора)
Алкилатор представляет собой вертикальный цилиндрический аппарат, футерованный графитовыми плитками во избежании коррозии. В алкилатор непрерывно подается каталитический комплекс, который готовится в отдельном аппарате, а также полиалкилбензолы, бензол и пропилен. За счет подачи газообразного пропилена реакционная масса аэрируется, а пропилен растворяется. Коэффициент аэрации достигает 1,2 – 1,3, т.е. объем жидкой фазы увеличивается почти на 20 – 30%. Реакционную массу отбирают на уровне 9 метров от точки ввода реагентов. Тепло экзотермической реакции снимается за счет частичного испарения бензола. Над зеркалом испарения в реакторе предусмотрен определенный объем для уменьшения уноса капельной жидкости из реактора. Как указывалось выше, комплекс Густавсона (дисперсная фаза) имеет более высокую плотность, чем дисперсионная среда (углеводородная фаза), в силу чего система расслаивается, и слой комплекса увеличивается по мере подачи новых порций комплекса. Это подтверждается тем, что количество хлорида алюминия, выносимое из реактора реакционной массой, намного меньше количества хлорида алюминия, вводимого в реактор (неопубликованные данные авторов). Так происходит до тех пор, пока весь реакционный объем не заполнится каталитическим комплексом. Поэтому далее реакция протекает в массе каталитического комплекса и идет с очень высокой скоростью. На основе аналогичных наблюдений в последствии была предложена технология производства ИПБ с реактором объемом около 1,5 м3 и производительностью 200 тыс. т/год. Гомогенное алкилирование бензола пропиленом (фирма Monsanto) отличается от вышеописанного метода тем, что процесс проводится при температуре существенно более высокой, когда комплекс Густавсона полностью растворяется в реакционной массе. При этом снимаются диффузионные ограничения, и скорость реакции становится приемлемой для промышленных условий в присутствии небольших количеств хлорида алюминия. При этом резко снижается расход хлорида алюминия и расходы на обработку реакционной массы.
|



 С6Н6 + С3Н6 С3Н7С6Н5 (С3Н7)2С6Н4
С6Н6 + С3Н6 С3Н7С6Н5 (С3Н7)2С6Н4



 С3Н6 С6Н12 С9Н18 С12Н24
С3Н6 С6Н12 С9Н18 С12Н24
 С6Н6 + С3Н6 С3Н7С6Н5 (С3Н7)2С6Н4
С6Н6 + С3Н6 С3Н7С6Н5 (С3Н7)2С6Н4 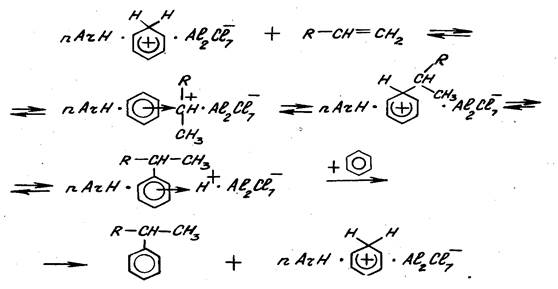
 (i-C3H7)2 C6H4 + C6H6 2 i-C3H7C6H5
(i-C3H7)2 C6H4 + C6H6 2 i-C3H7C6H5 


