Энергетическая функция
Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров. При отщеплении от аминокислот карбоксильной группы образуются амины:
Например, при окислении аминокислоты происходит отщепление аммиака с образованием кетонокислоты, которая распадается на альдегид и углекислоту.


Кетокислота Альдегид
Процесс дезаминирования и декарбоксилирования идут в мягких условиях под влиянием оксидазами аминокислот.
Трансаминирование — реакция переноса α -аминогруппы с АК на α -кетокислоту, в результате чего образуются новая α -кетокислота и новая АК. Процесс трансаминирования легко обратим, при нем общее количество АК в клетке не меняется.
На первой стадии реакции аминогруппа реагирует с карбонильной группой кетокислоты, образую нестойкое иминопроизводное. Переаминирование, катализируемое ферментами трансаминазами (аминотрансферазами), представляет собой взаимопревращение пары аминокислот и пары кетокислот. Реакции трансаминирования (переаминирование) обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма. У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все АК, за исключением лизина, треонина и пролина. Наибольшая роль переаминирования играет в биохимии в процессах метаболизма азотистых оснований в тканях животных и растений. Заключается в переносе аминогруппы от молекулы a-аминокислоты в молекулу a-кетокислоты, как правило с участием ферментов - аминотрансфераз (трансаминаз), например по реакции: (превращение глутаминовой кислоты в аспарагиновую) В живых организмах на реакциях такого типа основываются синтез и диссимиляция аминокислот.
Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат.
Механизм переаминирования
КЛАССИФИКАЦИЯ БЕЛКОВ
1) Простые (протеины) – состоят только из остатков аминокислот; 2) Сложные (протеиды) – при гидролизе образуют аминокислоты и другие соединения: а) нуклеопротеиды: белок+нуклеиновая кислота, растворимы в щелочах, не растворимы в кислотах; б) фосфопротеиды: белок + остаток фосфорной кислоты. Денатурируют при действии кислот (казеин молока); в) глюкопротеиды: белок + углерод. Нерастворимы в воде, растворимы в щелочах, нейтральны (слизь); г) хромопротеиды: белок + красящее вещество (гемоглобин). Ι Ι По растворимости: 1) Склеропротеины – нерастворимы в воде; 2) Альбумины – растворимы в воде; 3) Глобулины – растворимы в 70% этаноле; Гистоны и протамины – растворимы в щелочах СВОЙСТВА БЕЛКОВ
В органических растворителях (абсолютном спирте, эфире, бензоле и др.) белки нерастворимы. Растворы белков обладают свойствами, характерными для растворов высокомолекулярных соединений. В отличие от низкомолекулярных соединений белки не проходят через полупроницаемые перегородки (например, мембраны из коллодия, целлофана и т.д.). Этим их свойством пользуются для очистки белков от низкомолекулярных органических и неорганических веществ. Растворы белков очень нестойки. Это связано со способностью молекул белка гидратироваться. Любой фактор снижающий гидратацию белка понижает его растворимость и способствует выделению его из раствора. К таким водоотнимающим веществам относится спирт, ацетон, концентрированные растворы сульфата натрия, аммония, магния, хлористого натрия и т. д. Различные белки осаждаются из растворов при различных концентрациях осадителей (спирта, солей, ацетона). Этим свойством широко пользуются для разделения белков. Как и аминокислоты белки являются амфотерными соединениями – они образуют соли с кислотами и с основаниями. Так же как и аминокислоты, белки образуют в кислой среде катионы, а в щелочной – анионы, которые, при наложении электрического поля (тока) мигрируют к аноду или катоду (данное явление называется – электрофоре).
В органических растворителях (абсолютном спирте, эфире, бензоле и др.) белки нерастворимы.
Так например изоэлектрическая точка (рI) белков … лежит при следующих рН: Желатин -4, 2; Казеин – 4, 6; Альбумин яйца – 4, 8; Альбумин сыворотки крови -4, 8; Гемоглобин – 6, 8; Гистон зобной железы 8, 7.
Резко падает растворимость белка и увеличивается его способность к свертыванию.
ГИДРОЛИЗ И ДЕНАТУРАЦИЯ БЕЛКОВ
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства. Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов. Различают 2 вида денатурации: - обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности. - необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов. РЕАКЦИИ ХАРАКТЕРНЫЕ ДЛЯ БЕЛКОВ 1) 2) Концентрированными растворами минеральных солей; 3) Солями тяжелых металлов: хлорной ртутью (НgCI2); (CuSO4); (CH3COOCu); (CH3COOPb); 4) Кислотами: ТХУК, НNO3, CH3COOH; 5) Коллоидными растворами гидратов окиси железа [Fe(OH)3] алюминия [Al(OH)3]. При осаждении белков спиртом, ацетоном и концентрированными растворами минеральных солей белки не теряют способность снова переходить в раствор. Это используют для выделения и разделения белков. При действии остальных осадителей белки в значительной степени изменяют свои свойства (денатурируются), например, теряют способность растворяться в воде и солевых растворах. Белки можно денатурировать и физическими методами: нагреванием до температуры выше 60-70°C, облучением ультрафиолетовыми лучами, применением давления свыше 2500-3000 атм. Примером необратимого осаждения (денатурации) является свертывание яичного белка при нагревании, свертывание крови. Белки дают ряд цветных реакций.
|


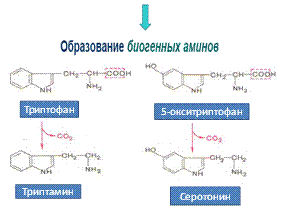

 Белки, после гидролиза первичной структуры (до аминокислот) могут подвергаться дезаминированию.
Белки, после гидролиза первичной структуры (до аминокислот) могут подвергаться дезаминированию.
 Аминокислоты реагируют также с кетокислотами и вступают в реакцию трансаминирования.
Аминокислоты реагируют также с кетокислотами и вступают в реакцию трансаминирования.

 Аминотрансферазы (более 50 разновидностей) содержат в качестве кофсрмента производные витамина В6-пири-доксаль-5'-фосфат (ф-ла I) и пиридоксамин-5'-фосфат (II). В основе каталитич. активности пиридоксаль-5'-фосфата лежит способность его формильной группы образовывать с аминокислотами шиффовы основания, легко гидролизующиеся до пиридоксамин-5'-фосфата и a-кетокислоты. Общая схема П. с участием этих ферментов представляет собой сумму двух полуреакций:
Аминотрансферазы (более 50 разновидностей) содержат в качестве кофсрмента производные витамина В6-пири-доксаль-5'-фосфат (ф-ла I) и пиридоксамин-5'-фосфат (II). В основе каталитич. активности пиридоксаль-5'-фосфата лежит способность его формильной группы образовывать с аминокислотами шиффовы основания, легко гидролизующиеся до пиридоксамин-5'-фосфата и a-кетокислоты. Общая схема П. с участием этих ферментов представляет собой сумму двух полуреакций: Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат.
Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат.
 Ι По стороению:
Ι По стороению: 1)Некоторые белки растворяются в воде (альбумины). Альбумин связывает и переносит билирубин, жирные кислоты, различные гормоны, ионы хлора, кальция, лекарственные вещества. Альбумины — белки, растворимые в воде и осаждающиеся в насыщенном растворе сульфата аммония; характеризуются относительно небольшим молекулярным весом (15000— 65000);
1)Некоторые белки растворяются в воде (альбумины). Альбумин связывает и переносит билирубин, жирные кислоты, различные гормоны, ионы хлора, кальция, лекарственные вещества. Альбумины — белки, растворимые в воде и осаждающиеся в насыщенном растворе сульфата аммония; характеризуются относительно небольшим молекулярным весом (15000— 65000); Все белки растворимы в щелочах, многие растворимы в кислотах и разбавленных растворах солей.
Все белки растворимы в щелочах, многие растворимы в кислотах и разбавленных растворах солей.
 При определенной величине рН раствора в молекуле белка устанавливается равенство положительных и отрицательных зарядов. В зависимости от числа и природы основных и кислых групп в белке это равенство (называемое ИЗОЭЛЕКТРИЧЕСКОЙ точкой) достигается, (у разных белков)при разных концентрациях водородных ионов (Н+). У белков содержащих больше основных аминокислот, изоэлектрическая точка лежит в щелочной зоне, а у кислых в кислой зоне.
При определенной величине рН раствора в молекуле белка устанавливается равенство положительных и отрицательных зарядов. В зависимости от числа и природы основных и кислых групп в белке это равенство (называемое ИЗОЭЛЕКТРИЧЕСКОЙ точкой) достигается, (у разных белков)при разных концентрациях водородных ионов (Н+). У белков содержащих больше основных аминокислот, изоэлектрическая точка лежит в щелочной зоне, а у кислых в кислой зоне. В изоэлектрической точке ионы белка не переносятся ни к аноду, ни к катоду. В этой точке достигают своего минимального значения такие свойства белков как: набухание, вязкость, электропроводность.
В изоэлектрической точке ионы белка не переносятся ни к аноду, ни к катоду. В этой точке достигают своего минимального значения такие свойства белков как: набухание, вязкость, электропроводность. Боковые цепи аминокислот (радикал) могут быть гидрофобными или гидрофильными, что придает белкам соответствующие свойства, которые проявляются при образовании вторичной, третичной и четвертичной структур белка.
Боковые цепи аминокислот (радикал) могут быть гидрофобными или гидрофильными, что придает белкам соответствующие свойства, которые проявляются при образовании вторичной, третичной и четвертичной структур белка. Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию α -аминокислот, из которых он был составлен.
Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию α -аминокислот, из которых он был составлен. Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов. Органическими растворителями: спирт, ацетон;
Органическими растворителями: спирт, ацетон;


