Защитные белки
Роль защитных белков выполняют иммуноглобулины (другое их название – антитела), они распознают антигены, проникшие в организм, и прочно связываются с ними. В организме млекопитающих, включая человека, есть пять классов иммуноглобулинов: M, G, A, D и E, их структура, как следует из названия, глобулярная, кроме того, все они построены сходным образом. Молекулярная организация антител показана на слайде на примере иммуноглобулина класса G. Молекула содержит четыре полипептидные цепи, объединенные тремя дисульфидными мостиками S-S (на слайде они показаны с утолщенными валентными связями и крупными символами S), кроме того, каждая полимерная цепь содержит внутрицепные дисульфидные перемычки. Две большие полимерные цепи (выделены синим цветом) содержат 400–600 аминокислотных остатков. Две другие цепи (выделены зеленым цветом) почти вдвое короче, они содержат приблизительно 220 аминокислотных остатков. Все четыре цепи расположены таким образом, что концевые H2N-группы направлены в одну сторону. После контакта организма с чужеродным белком (антигеном), клетки иммунной системы начинают вырабатывать иммуноглобулины (антитела), которые накапливаются в сыворотке крови. На первом этапе основную работу совершают участки цепей, содержащие концевые H2N (на рис. 27 соответствующие участки отмечены светло-синим и светло-зеленым цветом). Это области захвата антигенов. В процессе синтеза иммуноглобулина эти участки формируется таким образом, чтобы их строение и конфигурация максимально соответствовали структуре приблизившегося антигена (как ключ к замку, подобно ферментам, но задачи в данном случае иные). Таким образом, для каждого антигена в качестве иммунного ответа создается строго индивидуальное антитело. Столь «пластично» изменять строение в зависимости от внешних факторов, помимо иммуноглобулинов, не может ни один известный белок. Ферменты решают задачу структурного соответствия реагенту иным путем – с помощью гигантского набора разнообразных ферментов в расчете на все возможные случаи, а иммуноглобулины каждый раз заново перестраивают «рабочий инструмент». Сверх того, шарнирный участок иммуноглобулина обеспечивает двум областям захвата некоторую независимую подвижность, в результате молекула иммуноглобулина может «найти» сразу два наиболее удобных для захвата участка в антигене с тем, чтобы его надежно зафиксировать, это напоминает действия ракообразного существа. Далее включается цепь последовательных реакций иммунной системы организма, подключаются иммуноглобулины других классов, в результате происходит дезактивация чужеродного белка, а затем уничтожение и удаление антигена (постороннего микроорганизма или токсина). После контакта с антигеном максимальная концентрация иммуноглобулина достигается (в зависимости от природы антигена и индивидуальных особенностей самого организма) в течение нескольких часов (иногда нескольких дней). Организм сохраняет память о таком контакте, и при повторной атаке таким же антигеном иммуноглобулины накапливаются в сыворотке крови значительно быстрее и в большем количестве – возникает приобретенный иммунитет. Приведенная классификация белков носит в определенной степени условный характер, например белок тромбин, упомянутый среди защитных белков, по существу представляет собой фермент, катализирующий гидролиз пептидных связей, то есть, относится к классу протеаз. К защитным белкам часто относят белки змеиного яда и токсичные белки некоторых растений, поскольку их задача – уберечь организм от повреждений. Есть белки, функции которых настолько уникальны, что это затрудняет их классификацию. Например, белок монеллин, содержащийся в одном из африканских растений, – очень сладкий на вкус, он стал предметом изучения как нетоксичное вещество, которое может быть использовано вместо сахара для предотвращения ожирения. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, который предохраняет кровь этих рыб от замерзания. Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
Такие молекулы объединяются в крупные агрегаты, содержащие 300–400 молекул. При изменении концентрации ионов кальция в пространстве, окружающем мышечные волокна, происходит обратимое изменение конформации молекул – изменение формы цепи за счет поворота отдельных фрагментов вокруг валентных связей. Это приводит к сокращению и расслаблению мышц, сигнал для изменения концентрации ионов кальция поступает от нервных окончаний в мышечных волокнах. Искусственное сокращение мышц можно вызвать действием электрических импульсов, приводящих к резкому изменению концентрации ионов кальция, на этом основана стимуляция сердечной мышцы для восстановления работы сердца. Благодаря скольжению относительно друг друга актиновых (актины) и миозиновых (миозины) протофибрилл происходит сокращение мышц, а также немышечные внутриклеточные сокращения. Движение ресничек и жгутиков связано со скольжением относительно друг друга микротрубочек, имеющих белковую природу. Некоторые арктические и антарктические рыбы содержат в крови белки – антифризы, предотвращающие ее замораживание. Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков - тубулин, из которого построены клеточные органеллы - микротрубочки. Микротрубочки в период деления клетки регулируют расхождение хроматид. Микротрубочки - важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются. Однако существует большое количество белков, имеющих уникальные функции, которые не вошли в эту довольно простую классификацию.
К регуляторным белкам относят большую группу белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени. Многие гормоны являются олигопептидами или белками (например, инсулин, глюкагон [антагонист инсулина], адренокортикотропный гормон и др.). Гормон инсулин состоит из двух α -цепей, соединенных дисульфидными мостиками. Инсулин – гормон, образующийся в клетках островков Лангерганса в поджелудочной железе. Он играет важнейшую роль в метаболизме глюкозы в крови. Кроме того, к регуляторным относят белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Например, белок кальмодулин в комплексе с четырьмя ионами Са2+ может присоединяться к некоторым ферментам, меняя их активность. Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации. В гипофизе мозга синтезируется гормон, регулирующий рост организма. Существуют регуляторные белки, контролирующие биосинтез различных ферментов в организме. На рисунке показан - БЕЛОК ИНСУЛИН - в виде объемной модели и в форме третичной структуры. Состоит из двух α -спиральных цепей, связанных двумя дисульфидными мостиками (сравни с рис. 2, где его строение показано схематически)
7 Рецепторная (сигнальная) функция белков
Некоторые белки, встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку. Примером может служить фитохром — светочувствительный белок, регулирующий фотопериодическую реакцию растений, и опсин — составная часть родопсина пигмента -, интегральный мембранный белок, находящегося в клетках сетчатки глаза. Фитохром (от Фито... и греч. chroma – цвет, краска) голубой пигмент из группы сложных белков – хромопротеидов; присутствует в клетках фотосинтезирующих организмов. Впервые обнаружен американсканским биохимиком У. Батлером в 1959 в семядолях проростков турнепса, выращенных в темноте. Голубоватые фитохромы относятся к фотосинтетически неактивным пигментам. Однако установлено, что под контролем фитохрома находятся синтезы биополимеров (ДНК, РНК, белков), системы биосинтеза хлорофилла, каротиноидов, антоцианов, органических фосфатов, витаминов. Ф. ускоряет катаболитический распад полисахаридов, жиров и резервных белков, активирует клеточное дыхание и Окислительное фосфорилирование. Ферменты существует в двух взаимопревращаемых формах – Ф660 и Ф730, различных по спектрам поглощения. Под действием красного света с длина волны λ = 660 нм неактивный Ф660 превращается в активный Ф730. Обратное превращение происходит либо в темноте, либо при освещении красным светом с λ = 730 нм. Считают, что эти взаимопревращения обусловлены цис-транс-изомеризацией хромофора Ф. и конформационными перестройками белка. Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процесс через взаимодействие со специфическими белками рецепторами. Гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитолазме клеток. Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток. Наиболее важными из них являются фитохромы А и В (phyA and phyB). Фитохром А
Цикл основных изменений родопсина в палочках сетчатки
РОДОПСИН (от греч. rhodon - роза и opsis - зрение), зрительный пурпур, осн. зрительный пигмент палочек сетчатки позвоночных (кроме нек-рых рыб и земноводных на ранних стадиях развития) и беспозвоночных животных. По химич. природе родопсин - сложный белок (хромопротеид), в состав которого входит 11-цис-ретиналь (хромофорная группа), гликопротеид, т. е. белок, соединённый с сахарами, и липиды (т. н. опсино-вая часть). Мол. масса родопсина позвоночных ок. 40 000, головоногих моллюсков-ок. 70 000. Р.- осн. структурно-функциональный компонент наружного сегмента палочек (см. Зрение, Сетчатка, Фоторецепторы). Зрительный акт начинается поглощением Р. кванта света (максимум спектра поглощения Р.- ок. 500 нм). При этом происходит изомеризация 11-цис-ретиналя в полностью транс-форму (см. формулы), что приводит к постепенному разложению (фотолизу) молекулы Р., изменению ионного транспорта в фоторецепторе и возникновению электрич. сигнала, к-рый передаётся нервным элементам сетчатки. Регенерация Р. осуществляется или путём синтеза из 11-цис-ретиналя и освободившегося после фотолиза опсина, или при поглощении второго кванта одним из промежуточных продуктов фотолиза, а также в процессе синтеза новых дисков наружного сегмента сетчатки (последний путь для палочек основной). В клеточных оболочках некоторыхрых галофильных бактерий обнаружен пигмент, в состав которого также входят ретиналь, гликопротеид и липиды. Этот бактериальный радапсин (структура его окончательно не установлена), по-видимому, участвует в фотосинтезе наряду с др. пигментами бактерий.
Голубой фитохром 660 (Ф 660) имеет максимум поглощения в светло-красной области спектра с длиной волны 660 нм, а зелено-голубой фитохром 730 (Ф 730) - в темно-красной области спектра с длиной волны 730 нм. При освещении светло-красным светом неактивный Ф 660 превращается в физиологически активный Ф 730, а при освещении темно-красным светом происходит превращение Ф 730 в Ф 660.
К пищевым белкам относят альбумин – основной компонент яичного белка, а также казеин – главный белок молока. Под действием фермента пепсина казеин в желудке створаживается, это обеспечивает его задержку в пищеварительном тракте и эффективное усвоение. Казеин содержит фрагменты всех аминокислот, необходимых организму. В ферритине, который содержится в тканях животных, запасены ионы железа. К запасным белкам относят также миоглобин, по составу и строению напоминающий гемоглобин. Миоглобин сосредоточен, главным образом, в мышцах, его основная роль – хранение кислорода, который ему отдает гемоглобин. Он быстро насыщается кислородом (намного быстрее, чем гемоглобин), а затем постепенно передает его различным тканям при последующей физической нагрузке и кислородной недостаточности его высвободить.. Все это разнообразие функций проистекает из очень простого набора 20 аминокислот, из которых построена полипептидная цепь белка. Именно разное количество и разные сочетания этих аминокислот в цепи и определяет уникальность того или иного белка.
|

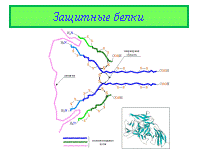 Защитные белки позволяют уберечь организм от вторжения атакующих его бактерий, вирусов и от проникновения чужеродных белков (обобщенное название чужеродных тел – антигены).
Защитные белки позволяют уберечь организм от вторжения атакующих его бактерий, вирусов и от проникновения чужеродных белков (обобщенное название чужеродных тел – антигены). 5 Сократительные и двигательные белки придают организму способность сокращаться, изменять форму и перемещаться, прежде всего, речь идет о мышцах. 40% от массы всех белков, содержащихся в мышцах, составляет миозин (mys, myos, греч. – мышца). Его молекула содержит одновременно фибриллярную и глобулярную часть.
5 Сократительные и двигательные белки придают организму способность сокращаться, изменять форму и перемещаться, прежде всего, речь идет о мышцах. 40% от массы всех белков, содержащихся в мышцах, составляет миозин (mys, myos, греч. – мышца). Его молекула содержит одновременно фибриллярную и глобулярную часть. 6 Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах.
6 Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах. МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи.
МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи. Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.
Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.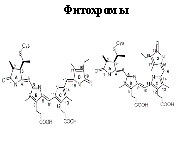 выполняет множество различных фоторегуляторных функций. При его участии происходит стимулирование и ингибирование проростания семян, индукция де-этиоляции, регуляция синтеза различных ферментов, регуляция развития корня, стимуляция цветения и регуляция циркадных ритмов.
выполняет множество различных фоторегуляторных функций. При его участии происходит стимулирование и ингибирование проростания семян, индукция де-этиоляции, регуляция синтеза различных ферментов, регуляция развития корня, стимуляция цветения и регуляция циркадных ритмов.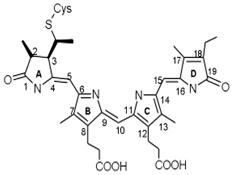




 Особое значение для действия фитохрома имеет его обратимость: этот хромопротеид (сложный белок, содержащий, кроме аминокислот, также окрашивающие компоненты) встречается в двух формах, способных преобразовываться одна в другую.
Особое значение для действия фитохрома имеет его обратимость: этот хромопротеид (сложный белок, содержащий, кроме аминокислот, также окрашивающие компоненты) встречается в двух формах, способных преобразовываться одна в другую.
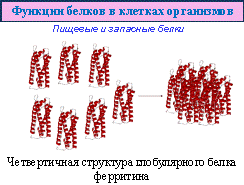 8 Пищевые и запасные белки, как следует из названия, служат источниками внутреннего питания, чаще для зародышей растений и животных, а также на ранних стадиях развития молодых организмов.
8 Пищевые и запасные белки, как следует из названия, служат источниками внутреннего питания, чаще для зародышей растений и животных, а также на ранних стадиях развития молодых организмов.


