Структурные белки
Структурные белки выполняют защитную функцию (кожные покровы) или опорную – скрепляют организм в единое целое и придают ему прочность (хрящи и сухожилия) Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Другие структурный беки (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие). Белки входят в состав: - клеточных мембран и матрикса органелл клетки; - стенок кровеносных сосудов, хрящей, сухожилий, суставных связок – белок – эластин, легко растягивающийся в двух измерениях; - роговые образования - волосы, ногти, рогова, перья, когти у высших животных – эти белки состоят преимущественно из белков – керотина – его основное отличие высокое содержание цистеина, образующего дисульфидные мостики, что придает высокую упругость (способность восстанавливать исходную форму после деформации) волосам, а также шерстяным тканям; - костей – белок – оссеин; - шелк, паутина – белок – фиброин; - белок, участвующий в образовании тромбов – фибрин.
При увеличении содержания остатков цистеина в кератине и, соответственно, возрастании количества дисульфидных мостиков способность к деформации исчезает, но при этом появляется высокая прочность (в рогах копытных животных и панцирях черепах содержится до 18% цистеиновых фрагментов). В организме млекопитающих содержится до 30 различных типов кератина. Родственный кератину фибриллярный белок фиброин, выделяемый гусеницами шелкопряда при завивке кокона, а также пауками при плетении паутины, содержит только β -структуры, соединенные одиночными цепями.
Белок фиброин, выделяемый гусеницами шелкопряда при завивке кокона, а также пауками при плетении паутины, содержит только β -структуры, соединенные одиночными цепями. Он содержат большое количество остатков глицина, аланина и серина (каждый второй аминокислотный остаток – глицин); остатки цистеина, содержащего сульфгидридные группы, отсутствуют. Фиброин – основной компонент натурального шелка и паутины, содержит β -структуры, соединенные одиночными цепями. В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы: гликопротеиды - содержащие в качестве простетической группы ковалентно связанные углеводные остатки (в образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды), липопротеиды, металлопротеиды, нуклеопротеиды, фосфопротеиды (ковалентно связанные остатки фосфорной кислоты с аминокислотой (серин и треонин - в казеине молока), хромопротеиды (гемоглобин).
1 — гликолипид, 2 — ионный канал, 3 — фосфолипид, 4 — интегральный белок, 5 — олигосахаридная боковая цепь, б — гидрофобный участок α —спирали, 7 — α —спиральная белковая молекула, 8 — холестерин, 9 — наружная поверхность, 10 — липидная сердцевина, 11 — внутренняя поверхность. Мембрана имеет толщину 8-12 нм и состоит из бимолекулярного слоя липидов, причем гидрофобные концы молекул фосфолипидов и триглицеридов направлены внутрь, а наружу - гидрофильные головки. В двойной слой липидов встроены белки, которые пронизывают липидный слой насквозь, либо погружены в него частично. Существуют периферийные белки, покрывающие некоторые мембраны с одной или двух сторон сетью вытянутых молекул. При этом молекулы фосфолипидов и белков находятся в непрерывном движении и взаимодействии. Липидный слой определяет основные структурные особенности биологических мембран, а белки ответственны за большинство функций мембран (транспорт, передача сигналов и т.д.). В активном состоянии мембрана имеет жидкую консистенцию, которая зависит от соотношения насыщенных и ненасыщенных жирных кислот. В настоящее время выявлено четыре основных механизма транспорта через цитоплазматическую мембрану как клетки, так и клеточных органелл: диффузия, осмос, активный транспорт, экзо- и эндоцитоз. Мембранные белки локализованы на поверхности мембраны или могут быть внедрены на различную глубину в гидрофобную зону. Некоторые белки пронизывают мембрану насквозь, и различные гидрофильные группы одного и того же белка обнаруживаются по обе стороны клеточной мембраны. Белки, обнаруженные в плазматической мембране, играют очень важную роль: они участвуют в образовании ионных каналов, играют роль мембранных насосов и переносчиков различных веществ, а также могут выполнять рецепторную функцию. 2 Каталитическая (ферментативная) функция
Ферменты - специализированные белки, другое их название – энзимы (en zumh греч. – в дрожжах) – это белки, обладающие каталитической активностью, они способны увеличивать скорости биохимических реакций в тысячи раз. Они обеспечивают фиксацию углерода при фотосинтезе, разложение перекиси водорода может катализироваться как просто ионами железа, так и железосодержащим белком каталазой. Ферменты принимают участие и во многих биохимических процессах синтеза, например, в синтезе белков (одни белки помогают синтезировать другие). Ферменты не только высокоэффективные, но и селективные катализаторы, (направляют реакцию строго в заданном направлении). В их присутствии реакция проходит практически со 100%-ным выходом без образования побочных продуктов и при этом условия протекания – мягкие: обычное атмосферное давление и температура живого организма. Для сравнения, синтез аммиака из водорода и азота в присутствии катализатора – активированного железа – проводят при 400–500°С и давлении 30 МПа, выход аммиака 15–25% за один цикл. В настоящее время известно около 2000 различных ферментов, ускоряющих различные химические реакции. Например, протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот - аргинина или лизина. Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи. Благодаря набору ферментов в клетках превращения поступающих в них веществ протекают не хаотично, а в строго определённых направлениях. Интенсивное исследование ферментов началось в середине 19 в., сейчас изучено более 2000 различных ферментов, это самый многообразный класс белков. Названия ферментов составляют следующим образом: к наименованию реагента, с которым взаимодействует фермент, или к названию катализируемой реакции добавляют окончание -аза, Например, аргиназа разлагает аргинин, декарбоксилаза катализирует декарбоксилирование, т.е. отщепление СО2 от карбоксильной группы:
Часто, для более точного обозначения роли фермента в его названии указывают и объект, и тип реакции, например, алкогольдегидрогеназа – фермент, осуществляющий дегидрирование спиртов. Для некоторых ферментов, открытых достаточно давно, сохранилось историческое название (без окончания –аза), например, пепсин (pepsis, греч. пищеварение) и трипсин (thrypsis греч. разжижение), эти ферменты расщепляют белки. Для систематизации ферменты объединяют в крупные классы, в основу классификации положен тип реакции, классы именуют по общему принципу – название реакции и окончание – аза. Далее перечислены некоторые из таких классов. Оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Входящие в этот класс дегидрогеназы осуществляют перенос протона, например алкогольдегидрогеназа (АДГ) окисляет спирты до альдегидов, последующее окисление альдегидов до карбоновых кислот катализируют альдегиддегидрогеназы (АЛДГ). Оба процесса происходят в организме при переработке этанола в уксусную кислоту. Наркотическим действием обладает не этанол, а промежуточный продукт ацетальдегид, чем ниже активность фермента АЛДГ, тем медленнее проходит вторая стадия – окисление ацетальдегида до уксусной кислоты и тем дольше и сильнее проявляется опьяняющее действие от приема внутрь этанола. Анализ показал, что более чем у 80% представителей желтой расы относительно низкая активность АЛДГ и потому заметно более тяжелая переносимость алкоголя. Причина такой врожденной пониженной активности АЛДГ состоит в том, что часть остатков глутаминовой кислоты в молекуле «ослабленной» АЛДГ заменена фрагментами лизина (табл. 1). Трансферазы – ферменты, катализирующие перенос функциональных групп, например, трансиминаза катализирует перемещение аминогруппы. Гидролазы – ферменты, катализирующие гидролиз. Упомянутые ранее трипсин и пепсин осуществляют гидролиз пептидных связей, а липазы расщепляют сложноэфирную связь в жирах: –RС(О)ОR1 +Н2О → –RС(О)ОН + НОR1 Лиазы – ферменты, катализирующие реакции, которые проходят не гидролитическим путем, в результате таких реакций происходит разрыв связей С-С, С-О, С-N и образование новых связей. Фермент декарбоксилаза относится к этому классу.
В работе ферментов соблюдается общий принцип, в соответствии с которым всегда есть структурное соответствие фермента и реагента ускоряемой реакции. По образному выражению одного из основателей учения о ферментах Э.Фишера, реагент подходит к ферменту, как ключ к замку. В связи с этим каждый фермент катализирует определенную химическую реакцию или группу реакций одного типа. Иногда фермент может действовать на одно единственное соединение, например, уреаза (греч. uron– моча) катализирует только гидролиз мочевины: (H2N)2C = O + H2O = CO2 + 2NH3 Наиболее тонкую избирательность проявляют ферменты, различающие оптически активные антиподы – лево- и правовращающие изомеры. L-аргиназа действует только на левовращающий аргинин и не затрагивает правовращающий изомер. L-лактатдегидрогеназа действует только на левовращающие эфиры молочной кислоты, так называемые лактаты (lactis лат. молоко), в то время как D-лактатдегидрогеназа расщепляет исключительно D-лактаты. Большая часть ферментов действует не на одно, а на группу родственных соединений, например, трипсин «предпочитает» расщеплять пептидные связи образованные лизином и аргинином.
В работе ферментов соблюдается общий принцип, в соответствии с которым всегда есть структурное соответствие фермента и реагента ускоряемой реакции. По образному выражению одного из основателей учения о ферментах Э.Фишера, реагент подходит к ферменту, как ключ к замку.
Иногда фермент может действовать на одно единственное соединение, например, уреаза (uron греч. – моча) катализирует только гидролиз мочевины: (H2N)2C = O + H2O = CO2 + 2NH3
|

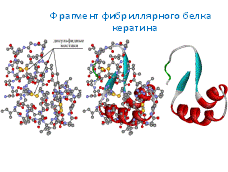 Для необратимого изменения формы кератинового объекта нужно вначале разрушить дисульфидные мостики с помощью восстановителя, придать новую форму, а затем вновь создать дисульфидные мостики с помощью окислителя, так делается химическая завивка волос.
Для необратимого изменения формы кератинового объекта нужно вначале разрушить дисульфидные мостики с помощью восстановителя, придать новую форму, а затем вновь создать дисульфидные мостики с помощью окислителя, так делается химическая завивка волос. В отличие от кератина, у фиброина нет поперечных дисульфидных мостиков, он обладает очень прочен на разрыв (прочность в расчете на единицу поперечного сечения у некоторых образцов паутины выше, чем у стальных тросов). Из-за отсутствия поперечных сшивок фиброин неупруг (известно, что шерстяные ткани почти несминаемы, а шелковые легко мнутся).
В отличие от кератина, у фиброина нет поперечных дисульфидных мостиков, он обладает очень прочен на разрыв (прочность в расчете на единицу поперечного сечения у некоторых образцов паутины выше, чем у стальных тросов). Из-за отсутствия поперечных сшивок фиброин неупруг (известно, что шерстяные ткани почти несминаемы, а шелковые легко мнутся). Трехмерная схема жидкостно-мозаичной модели мембраны Сингера- Николсона; изображены глобулярные интегральные белки, погруженные в липидный бислой. Часть белков является ионными каналами, другие (гликопротеины) содержат олигосахаридные боковые цепи, участвующие в узнавании клетками друг друга и в межклеточной. Молекулы холестерола вплотную примыкают к фосфолипидным головкам и фиксируют прилегающие участки " хвостов". Внутренние участки хвостов молекулы фосфолипидов не ограничены в своем движении и ответственны за текучесть мембраны (Bretscher, 1985).
Трехмерная схема жидкостно-мозаичной модели мембраны Сингера- Николсона; изображены глобулярные интегральные белки, погруженные в липидный бислой. Часть белков является ионными каналами, другие (гликопротеины) содержат олигосахаридные боковые цепи, участвующие в узнавании клетками друг друга и в межклеточной. Молекулы холестерола вплотную примыкают к фосфолипидным головкам и фиксируют прилегающие участки " хвостов". Внутренние участки хвостов молекулы фосфолипидов не ограничены в своем движении и ответственны за текучесть мембраны (Bretscher, 1985). Белки-ферменты катализируют протекание всех химических реакций в организме. Под действием ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем синтезируются новые макромолекулы, необходимые организму определенного типа.
Белки-ферменты катализируют протекание всех химических реакций в организме. Под действием ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем синтезируются новые макромолекулы, необходимые организму определенного типа. – СООН → – СН + СО2
– СООН → – СН + СО2 Изомеразы – ферменты, катализирующие изомеризацию, например, превращение малеиновой кислоты в фумаровую, это пример цис – транс изомеризации.
Изомеразы – ферменты, катализирующие изомеризацию, например, превращение малеиновой кислоты в фумаровую, это пример цис – транс изомеризации.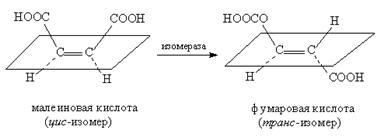
 Каталитические свойства некоторых ферментов, таких как гидролазы, определяются исключительно строением самой белковой молекулы, другой класс ферментов – оксидоредуктазы (например, алкогольдегидрогеназа) могут проявлять активность только в присутствии связанных с ними небелковых молекул – витаминов, активирующих ионов Mg, Са, Zn, Мn и фрагментов нуклеиновых кислот.
Каталитические свойства некоторых ферментов, таких как гидролазы, определяются исключительно строением самой белковой молекулы, другой класс ферментов – оксидоредуктазы (например, алкогольдегидрогеназа) могут проявлять активность только в присутствии связанных с ними небелковых молекул – витаминов, активирующих ионов Mg, Са, Zn, Мn и фрагментов нуклеиновых кислот. В связи с этим каждый фермент катализирует определенную химическую реакцию или группу реакций одного типа.
В связи с этим каждый фермент катализирует определенную химическую реакцию или группу реакций одного типа.


