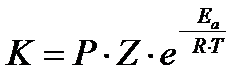Механизм действия ферментов
Ферменты обладают рядом общекаталитических свойств: · не смещают каталитическое равновесие; · не расходуются в процессе реакции; · катализируют только термодинамически реальные реакции. Такими реакциями являются те, в которых исходный энергетический запас молекул больше, чем финальный. В ходе реакции преодолевается высокий энергетический барьер. Разница между энергией этого порога и исходным энергетическим уровнем - энергия активации.
Скорость ферментативных реакций определяется энергией активации и рядом других факторов. Константа скорости химической реакции определяется по уравнению:
К - константа скорости реакции; Р – пространственный (стерический) коэффициент; Z – количество взаимодействующих молекул; Еа – энергия активации; R – газовая постоянная; Т – универсальная абсолютная температура; е – основание натуральных логарифмов. В этом уравнении Z, е, R, T – постоянные величины, а Р и Еа - переменные. Причём, между скоростью реакции и стерическим коэффициентом зависимость прямая, а между скоростью и энергией активации – обратная и степенная зависимость (чем ниже Еа, тем выше скорость реакции). Механизм действия ферментов сводится к увеличению ферментами стерического коэффициента и уменьшению энергии активации.
|