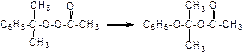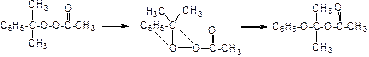Теория столкновений. Закон действия масс
Простая бимолекулярная реакция представляет собой совокупность однотипных элементарных реакций: А + ВС ® продукты. Сосредоточим внимание на реагентах элементарной химической реакции. Стрелка указывает, что реакция односторонняя (необратимая). Необратимая реакция завершается количественным превращением исходных веществ в продукты реакции. Между собой частицы А не реагируют. Это же условие выполняется и для частиц ВС. Теория соударений опирается на положение о том, что реакция происходит только тогда, когда частицы одного реагента (А) сталкиваются с частицами другого реагента (ВС). Число столкновений, которое может привести к элементарному химическому акту, прямо пропорционально произведению концентраций реагирующих веществ(рис. 51).
Рис. 51. Модель подсчета числа столкновений реагентов А и ВС, способных привести к химической реакции Сущность основного закона химической кинетики (закона действия масс) заключается в том, что скорость простой бимолекулярной реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ. u = k × cA × cBC, (5.2) где k – константа скорости реакции, учитывающая то обстоятельство, что не все соударения реагентов А и ВС приводят к химическому превращению. Соударение частиц-реагентов есть лишь первое необходимое условие осуществления химической реакции. Из всех возможных соударений между частицами А и ВС участвуют в превращении только такие пары реагентов, энергия столкновения которых (кинетическая энергия, энергия движения), переходя в потенциальную (разрыв химических связей), равна или превышает энергию активации Е. Кроме того, реагирующие частицы при столкновении с достаточной энергией (энергией активации Е) должны быть определенным образом ориентированы. Лишь столкновение реакционными центрами приведет к результату. Под реакционным центром подразумевается химическая связь, разрывающаяся и образующаяся в ходе превращения реагентов. Например, взаимодействие спирта и органической кислоты приведет к результату, если сблизятся их реакционные центры – функциональные группы –СООН и –ОН.
Таким образом, теория соударений выделяет три условия, обеспечивающие химическое превращение реагентов: 1) столкновение реагентов; 2) столкновение с энергией активации Е; 3) столкновение реакционными центрами. Если кинетической энергии (энергии движения) сталкивающихся частиц недостаточно для химического превращения, приходится нагревать смесь реагентов, используя внешний источник энергии (нагреватель). При повышении температуры все большее число молекул реагентов движутся со скоростью, достаточной для разрыва и образования химических связей. О таких сталкивающихся молекулах реагентов мы говорим, что они преодолевают активационный барьер Е. Шведский физико-химик Сванте Аррениус эмпирически установил (1889 г.) зависимость константы скорости химической реакции k от температуры. k = k 0 × где k 0 – предэкспоненциальный множитель. Введем в уравнение (5.2) выражение константы скорости реакции из уравнения (5.3): u = k 0 × В уравнении (5.4) произведение концентраций реагентов cА × cВС учитывает число возможных соударений (первый фактор теории соударений), множитель Для оценки влияния температуры на скорость реакции используют также эмпирическое правило Вант-Гоффа: при увеличении температуры на 10 0С скорость реакции увеличивается в 2 – 4 раза. Несложно подсчитать, насколько примерно возрастет скорость реакции по уравнению
И уравнение Аррениуса, и правило Вант-Гоффа свидетельствуют о том, что с ростом температуры константа скорость реакции возрастает экспоненциально (рис. 52).
Рис. 52. Экспоненциальный характер зависимости константы скорости реакции от температуры
По мере увеличения температуры скорость реакции может достигать таких величин, что становится неконтролируемой, и это может привести к тепловому взрыву. Простая мономолекулярная реакция представляет собой совокупность однотипных элементарных актов: А ® продукты. Реакция односторонняя, необратимая. Между собой частицы А при столкновении не реагируют, но способны обмениваться кинетической энергией. Примером простой мономолекулярной реакции может служить перегруппировка кумилперацетата:
Для элементарной мономолекулярной реакции, так же как и для бимолекулярной реакции, выполняются условия: 1) столкновение частиц А с молекулами растворителя или между собой; 2) столкновение, обеспечивающее получение реагентом энергии, равной энергии активации Е; 3) сосредоточение энергии движения на тех связях, которые должны быть разорваны (реакционный центр). Столкновение молекул реагента А между собой или с молекулами нагретого до высокой температуры растворителя (М*) являются источником энергии активации Е. Энергия движения атомов в молекуле реагента должна быть сосредоточена на тех химических связях, которые подвергаются разрыву для образования новых связей. Механизм такого процесса на примере перегруппировки кумилперацетата показан ниже:
Реакция перегруппировки идет в один акт, в одно действие с количественным выходом конечного продукта реакции.
|


 RCOOH + HOR ® RCOOR + H2O
RCOOH + HOR ® RCOOR + H2O , (5.3)
, (5.3) .
.