Каталитические реакции
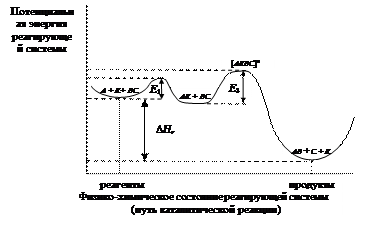
Каталитическая реакция происходит с более высокой скоростью при введении вещества – катализатора. Катализатор – химическое соединение, обладающее замечательным качеством. Катализатор участвует в химических превращениях и увеличивает скорость реакции, но после завершения процесса остается в неизменном состоянии и количестве. В человеческом организме насчитывается несколько тысяч белков – катализаторов (ферментов). Каждый из них катализирует определенную химическую реакцию. Заметим, что при температуре 36.6 – 37.0 0С в человеческом организме протекает с высокой скоростью громадное количество каталитических реакций. Ни один химический реактор, созданный руками человека, не обладает такой уникальностью. Различают гомогенные и гетерогенные химические реакции. В первом случае реагенты и катализатор находятся в одной фазе. Так осуществляются реакции в растворах. Во втором случае реагенты находятся в жидкой или газовой фазе, а катализатор – твердое вещество. Рассмотрим гомогенную каталитическую реакцию. Основная причина ускорения химической реакции в присутствии катализатора состоит в том, что он снижает энергию активации реакции (рис. 54).
Рис. 54. Энергетический профиль реагирующей системы; Е – активационный барьер; D Нr – энтальпия химической реакции
Сравним последовательность превращений без катализатора и с участием катализатора. Реакция в отсутствии катализатора: А + ВС ® АВ + С
Каталитическая реакция (К – катализатор ) может идти в несколько стадий, например А + К ⇄ АК АК+ ВС ® АВ+ С + К. За быстрой обратимой реакцией А + К ⇄ АК следует медленная, реакция АК+ ВС ® АВ+ С + К, ограничивающая скорость всего процесса. Запишем скорости элементарных стадий каталитической реакции 1) А + К ® АК,
2) АК ® А + К,
3) АК+ ВС ® АВ+ С + К,
Энергия активации (Е) некаталитической реакции (рис. 53) существенно выше энергий активации каталитических реакций (рис. 54). Это обстоятельство объясняет высокую скорость каталитической реакции по сравнению с некаталитической. Лимитирующей стадией каталитической реакции является реакция (3): АК+ ВС ® АВ+ С + К, u 3= k 3× сАК × сВС. (5.5) В установившемся стационарном каталитическом процессе скорость образования и расходования промежуточного комплекса АК не меняется k 1 сАсК – k 2 сАК – k 3 сАКсВС = 0,
Концентрацию комплекса сАК из уравнения (5.6) подставим в уравнение (5.5):
Возможны два предельных варианта течения каталитического процесса. Если скорость разложения промежуточного продукта АК во много раз больше скорости каталитического образования продуктов АВ и С, т.е. k 2 > > k 3 сВС, то уравнение (5.7) примет вид:
Примем во внимание, что концентрация катализатора есть величина постоянная, тогда скорость реакции выразится уравнением
Если скорость разложения промежуточного продукта АК во много раз меньше скорости каталитического образования продуктов АВ и С, т.е. k 2 < < k 3 сВС, то уравнение (5.7) примет вид:
u = kcA, где k = k 1 cK. Полученные уравнения демонстрируют, каким образом скорость реакции зависит от концентрации катализатора.
|

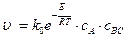
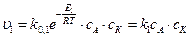 .
.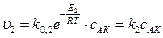 .
. .
.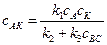 . (5.6)
. (5.6)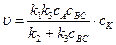 (5.7)
(5.7)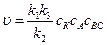 .
.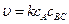 , где
, где 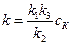 .
.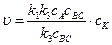 или
или


