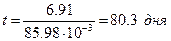Реакции первого порядка
Рассмотрим применение основного закона кинетики к простым односторонним (необратимым) реакциям. Для реакции первого порядка А ® продукты реакции
Разделим переменные и интегрируем уравнение в пределах от начальной концентрации сА = с 0 (при t = 0) до сА = с, соответствующей моменту времени t.
Введем понятие период полураспада t1/2 – время, за которое превращается половина исходного реагента. К моменту времени t1/2 концентрация исходного вещества А уменьшается наполовину сА = с 0/2. Подставим в уравнение (5.12) время, соответствующее периоду полураспада вещества А:
Как видно, период полураспада мономолекулярной реакции не зависит от концентрации реагирующего вещества и определяется значением константы скорости реакции. За промежуток времени, равный периоду полураспада, превращается половина текущей концентрации реагента (рис. 55). Если t 1/2 вещества А равен 5 мин, то при любой концентрации вещества А за отрезок времени, равный 5 мин, эта концентрация уменьшится вдвое. Воспользовавшись уравнением (5.12), представим зависимость текущей концентрации реагента А от времени
Рис. 55. График изменения концентрации вещества А от времени реакции
Пример. Классическим процессом, подчиняющимся уравнению реакции первого порядка, является радиоактивный распад. Например, известно, что радиоактивный йод
Период полураспада йода-131 равен 8.06 дня. Вычислим время, которое потребуется, чтобы относительное содержание иода-131, оказавшееся в щитовидной железе человека, уменьшилось в 1000 раз. Решение. Вычислим константу скорости радиоактивного распада по уравнению (5.13):
Подставим значение константы скорости превращения радиоактивного иода-131 в уравнение (5.12)
В течение 80 дней человек, в щитовидную железу которого попал радиоактивный йод-131, подвергается опасному облучению, прежде чем концентрация его уменьшится в 1000 раз.
|

 .
. ,
, ,
, . (5.12)
. (5.12) ,
, . (5.13)
. (5.13) . (5.14)
. (5.14)
 распадается с выделением из ядра атома электрона (b -распад) и образованием инертного газа – ксенона-131:
распадается с выделением из ядра атома электрона (b -распад) и образованием инертного газа – ксенона-131:
 ,
, .
. ,
,