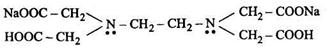Основные титранты и первичные стандарты метода
Хотя число комплексонов в настоящее время составляет не одну сотню, под термином «комплексонометрия» («хелатометрия») обычно подразумевают титрование солями этилендиаминтетрауксусной кислоты, чаще всего двузамещенной натриевой солью Na2H2Y • 2Н2О, широко известной под названием комплексен III, трилон Б. Структурно-графическая формула этого соединения:
Анализ структуры ЭДТА показывает его способность к образованию в общей сложности шести связей с катионом металла. Четыре из них — ионные, образуются при замещении двух ионов натрия и двух ионов водорода у карбоксильных групп катионом определяемого металла. Кроме того, молекула ЭДТА содержит два атома азота, имеющих по неподеленной паре электронов, и поэтому обладает потенциальной возможностью образовывать еще две связи по донорно-акцепторному механизму с этим же катионом. Исходя из изложенного, молекулу ЭДТА можно рассматривать как гексадентатный лиганд. Таким образом, основным рабочим раствором комплексонометрии является Na2H2Y • 2Н2О. Эта соль легко получается в чистом виде, хорошо растворима в воде, растворы устойчивы при хранении. В обычных условиях препарат содержит примерно 0, 3 % влаги, поэтому титрованные растворы ЭДТА можно - приготовить по точной навеске (с учетом 0, 3 % Н2О). Однако обычно его концентрацию устанавливают по раствору соли цинка, полученному растворением точной навески металлического цинка в соляной кислоте или по раствору соли магния, приготовленному из фиксанала. Применяемые для титрования растворы ЭДТА имеют концентрацию 0, 01-0, 05 моль/л и реже - 0, 1 моль/л. Наиболее ценным свойством ЭДТА как титранта является его способность реагировать с ионами металлов в соотношении 1: 1 независимо от заряда катиона. Эти реакции могут быть записаны в виде:
Ме2+ + H2Y2- ↔ MeY2- + 2H+ ; Ме3+ + + H2Y2- ↔ MeY- + 2H+ ;
Ме4+ + H2Y2- ↔ MeY + 2H+ ,
где H2Y2- - анион двузамещенной соли ЭДТА. В какой-то мере все катионы реагируют с ЭДТА, за исключением катионов щелочных металлов. Высокая устойчивость комплексов обусловлена наличием в молекуле ЭДТА нескольких донорных групп. Упрощенная схема взаимодействия ЭДТА с ионом, двухвалентного металла, например Са2+ с образованием хелатного соединения может выглядеть так:
Na2H2Y2- + Ca2+ ↔ Na2CaY +2H+
Поскольку ЭДТА может образовывать хелаты с большинством катионов, на первый взгляд кажется, что это малоизбирательный реагент. В действительности же регулирование рН раствора позволяет в значительной степени контролировать поведение ЭДТА. При взаимодействии иона металла и ЭДТА в процессе титрования происходит выделение ионов водорода. Учитывая обратимость этого взаимодействия, полноту протекания реакции увеличивают при повышении рН раствора, что достигается введением в раствор аммиачного буфера или щелочи. В некоторых случаях, однако, при повышении рН может образовываться гидроксид металла. Поэтому при работе с комплексоном добиваются оп-имального значения рН раствора, зависящего от прочности комплекса и растворимости соответствующего гидроксида. Например, ион Fe3+ образует очень прочный комплекс с трилоном Б и очень труднорастворимый гидроксид. Реакция комплексообразования может протесать при рН не выше 3. Катион кальция, наоборот, образует сравнительно хорошо растворимый гидроксид и малоустойчивый комплекс, реакция с комплексоном возможна при рН 9 - 10.
|