Фотоколориметрия
По сравнению с визуальными методами фотоколориметрический метод является наиболее объективным и дает более точные результаты. В методе применяются фотоэлектроколориметры (ФЭК) различных марок. Принцип работы ФЭКа заключается в следующем. Световой поток, проходя через окрашенный раствор, частично поглощается. Остальная часть попадает на фотоэлемент, который преобразует световую энергию в электрическую. Возникающий в фотоэлементе ток регистрируется с помощью микроамперметра. В аналитической практике используется несколько марок фотоколориметров: ФЭК-56, ФЭК-56М, КФК, КФК-2 и др. Они предназначены для измерения пропускания или оптической плотности растворов в диапазоне 315-630 нм, а КФК-2 (рис. 24.3) - в области спектра 350-980 нм. Приборы позволяют также производить относительные измерения интенсивности рассеяния взвесей, эмульсий и коллоидных растворов в проходящем свете. Все приборы снабжены набором светофильтров. Светофильтр ставится на пути светового потока и пропускает
Рис. 24.3. Общий вид прибора КФК-2
определенную часть спектра. Он применяется для выделения той области спектра, которая максимально поглощается веществом. Светофильтр подбирают экспериментально. С этой целью готовят минимальную концентрацию окрашенного раствора и наблюдают его поглощение при данной рабочей длине (толщине) кюветы с разными светофильтрами. Для работы выбирается тот светофильтр, при котором наблюдается максимальное поглощение раствора. Иногда при подборе светофильтра для фотометрирования используют менее точный, но более быстрый прием, выбирая светофильтр по Цвету анализируемого раствора (табл. 24.1). Например, при фотометрировании растворов с желтой окраской используют синий светофильтр, поскольку растворы желтого цвета поглощают синюю часть спектра. Перед тем как приступить к работе на фотоколориметре, необходимо детально изучить инструкцию, прилагаемую к прибору. Измерения на приборе проводят спустя 15-20 мин после включения. В течение этого времени устанавливается режим накала лампы осветителя. Таблица 24.1. Цвета растворов и соответствующих им светофильтров
Кюветы, в которые наливают окрашенные растворы, должны быть тщательно вымыты. При постановке кювет в кюветное отделение надо следить за тем, чтобы они располагались на одинаковом расстоянии от светофильтра. Кюветы берут за стенки, через которые не проходит поток электромагнитного излучения. Оптическую плотность стандартного и анализируемого растворов всегда измеряют по отношению к раствору сравнения,
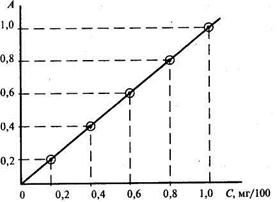
Рис. 24.4. Градуировочный график
или нулевому раствору. В качестве такого раствора можно использовать раствор, содержащий все добавляемые реактивы, кроме определяемого вещества. Если же все компоненты раствора сравнения и добавляемый реагент бесцветны и, следовательно, не поглощают лучей в видимой части спектра, то в качестве раствора сравнения можно использовать дистиллированную воду. Определение концентрации растворов на фотоколориметрах проводят обычно с помощью градуировочного графика (рис. 24.4). Градуировочный график отражает связь между оптической плотностью А (ранее обозначаемой буквой Д) и концентрацией С вещества в сериях стандартных растворов. Оптическую плотность называют также абсорбцией (А). Для построения градуировочного графика готовят стандартный раствор, содержащий строго определенное количество исследуемого вещества. Из этого стандартного раствора готовят серию стандартных растворов с постепенно возрастающими концентрациями определяемого вещества. С этой целью точно измеренные объемы исходного стандартного раствора переносят в мерные колбы вместимостью 100 мл и добавляют соответствующие реактивы, вызывающие окраску анализируемого раствора. Затем содержимое каждой колбы доводят дистиллированной водой до метки. Определение оптической плотности приготовленных стандартных растворов начинают с раствора, окрашенного слабее других. По полученным данным строят градуировочный график. На оси абсцисс откладывают значения концентраций стандартных растворов (размерности концентраций могут быть любыми); на оси ординат - величины их оптических плотностей. Приготовление стандартных и анализируемого растворов проводят в строго одинаковых условиях. В дальнейшем по градуировочному графику определяют концентрацию вещества в анализируемом растворе, зная его оптическую плотность. Градуировочный график, построенный для определения какого-либо вещества, справедлив только для определения данного вещества по данной методике. Определение железа. Ионы трехвалентного железа в кислой среде взаимодействуют с роданид-ионами и, в зависимости от концентрации последних, образуют ряд комплексов. В растворе могут существовать железороданидные комплексы с координационным числом от 1 до 6. Поэтому при определении железа применяют большой избыток роданида, при котором образуется соединение Fe(SCN)3:
Fe3+ + 3SCN- ↔ Fe(SCN)3.
Лабораторная работа 1. Определение ионов железа методом стандартного ряда. Цель работы. Приобрести навыки колориметрического определения ионов трехвалентного железа. Оборудование. Колориметрические или простые пробирки. Реактивы. 1. Стандартный раствор соли железа (III), который готовят следующим образом: 0, 8640 г железоаммонийных квасцов NH4Fe(SO4)2 • 12Н2О растворяют в мерной колбе вместимостью 1 л в 200-300 мл воды, добавляют 30 мл х.ч. серной кислоты (1: 5) и доводят водой до метки. Приготовленный таким образом раствор содержит 0, 1 мг железа в 1 мл. 2. Соляная кислота, разбавленная (1: 1). 3. 5М раствор роданида аммония NH4SCN готовят путем растворения 370 г его в дистиллированной воде и разбавляют водой до 1 л. Выполнение работы. 10 мл стандартного раствора соли железа (III) помещают в мерную колбу вместимостью 100 мл и разбавляют водой до метки. Полученный раствор содержит 0, 01 мг железа в 1 мл раствора. Анализируемый раствор помещают в мерную колбу вместимостью 100 мл, разбавляют водой до метки и тщательно перемешивают. В 10 пробирок с помощью градуированной пипетки вносят соответственно5, 0; 4, 5; 4, 0; 3, 5; 3, 0; 2, 5; 2, 0; 1, 5; 1, 0; 0, 5 мл разбавленного стандартного раствора. В одну пробирку вносят 5 мл анализируемого раствора. В каждую пробирку добавляют 4 капли раствора соляной кислоты (1: 1) и 1 мл раствора роданида аммония NH4SCN. Содержимое каждой пробирки доводят до объема 10 мл и хорошо перемешивают. Сравнивают окраску анализируемого раствора с окраской растворов в пробирках шкалы. Сравнение проводят на белом фоне при одинаковом освещении. Необходимо избегать прямого попадания солнечных лучей на пробирки с растворами. Если при сравнении окраска анализируемого раствора совпадает с окраской раствора в какой-либо пробирке шкалы, то концентрации таких растворов одинаковы. Если интенсивность окраски анализируемого раствора является средней между интенсивностью окраски двух соседних стандартных растворов, то концентрацию анализируемого раствора можно считать средней между концентрациями этих стандартных растворов. Делают вывод о концентрации ионов железа в анализируемом растворе.
Лабораторная работа 2. Определение ионов железа методом уравнивания окраски. Цель работы. Приобрести навыки определения ионов железа методом уравнивания окраски. Оборудование. Мерные колбы, цилиндры Генера. Реактивы. Хлороводородная кислота (1: 1). Остальные см. в лабораторной работе 1. Выполнение работы. В мерную колбу вместимостью 100 мл вносят 3 мл стандартного раствора соли железа (III), а в другую — анализируемый раствор. Затем в обе колбы добавляют воды до половины, по 10 капель хлороводородной кислоты и по 2 мл раствора роданида аммония NH4SCN. Доводят содержимое колб до метки, закрывают пробкой и тщательно перемешивают, опрокидывая колбы вверх дном. Стандартный раствор наливают в цилиндр Генера и устанавливают определенную высоту столба (до середины цилиндра). В другой цилиндр наливают анализируемый раствор. Предварительно каждый цилиндр ополаскивают тем окрашенным раствором, который будут в него наливать. Меняя высоту столба анализируемого раствора, уравнивают интенсивность окраски в обоих цилиндрах. Определение повторяют 2 раза и берут среднее значение. Рассчитывают содержание ионов железа в анализируемом растворе по формуле (24.7). Делают вывод о содержании ионов железа в растворе.
Лабораторная работа 3. Фотоколориметрическое определение ионов железа в растворе. Цель работы. Приобрести навыки определения ионов железа в растворе фотоколориметрическим методом. Оборудование. ФЭК любой марки, мерные колбы вместимостью 50 мл. Реактивы. Те же, что в лабораторных работах 1 и 2. Выполнение работы. В мерную колбу вместимостью 50 мл помещают точный объем раствора неизвестной концентрации, добавляют 5 капель хлороводородной кислоты, добавляют воды до половины колбы и 1 мл раствора NH4SCN. Доводят содержимое колбы водой до метки и перемешивают. Определяют оптическую плотность раствора при 500—560 нм (см. табл. 24.1) и в кювете с рабочей толщиной 1 см. По градуировочному графику определяют содержание ионов железа в растворе. Делают вывод о содержании ионов железа в растворе.
Лабораторная работа 4. Фотоколориметрическое определение ионов кальция с кислотным хром синим К. Ионы кальция образуют окрашенное соединение с кислотным хром синим К при рН = 12. Концентрацию ионов кальция в исследуемом растворе определяют с Помощью градуировочного графика, построенного по стандартным растворам хлорида кальция. Цель работы. Приобрести навыки колориметрического определения ионов кальция в растворе. Оборудование. ФЭК любой марки, аналитические весы, мерные колбы вместимостью 25 мл, пипетки. Реактивы. Кислотный хром синий К (раствор с массовой долей 0, 1 %), раствор гидроксида натрия с массовой долей 2 %, стандартный раствор хлорида натрия. Выполнение работы. В мерную колбу вместимостью 25 мл помещают 0, 5-15 мл «исследуемого раствора соли кальция, добавляют 1 мл раствора кислотного хром синего К, 1 мл раствора NaOH, доводят водой до метки и перемешивают. Оптическую плотность окрашенного раствора измеряют в кювете с толщиной слоя 2 см при 480 нм (синий светофильтр). В качестве раствора сравнения используют те же реактивы, что и в исследуемом растворе. Максимальная окраска раствора развивается сразу же после добавления кислотного хром синего К и остается постоянной в течение 2-3 ч. Линейная зависимость между концентрацией ионов кальция и оптической плотностью раствора наблюдается в интервале 1-30 мкг в растворе объемом 25 мл. Для построения градуировочного графика 0, 5466 г х.ч. СаСl2 • 6Н2О растворяют в воде в мерной колбе вместимостью 1 л. 2 мл этого раствора переносят в мерную колбу вместимостью 100 мл, доводят водой до метки и перемешивают. 1 мл такого стандартного раствора хлорида кальция содержит 2 мкг ионов кальция. Этот раствор используют для построения градуировочного графика. С этой целью стандартные растворы хлорида кальция объемом 1, 0; 2, 5; 5, 0; 10, 0; 12, 5 мл, содержащие соответственно 2, 5, 10, 20, 25 мкг ионов кальция, обрабатывают также, как и анализируемый раствор.
Лабораторная работа 5. Фотоколориметрическое определение ионов магния с эриохромом черным Т. Эриохром черный Т образует с ионами магния окрашенное (красное) соединение при рН 10. Окраска соединения неустойчива, поэтому оптическую плотность определяют сразу же после смешивания всех растворов. Цель работы. Приобрести навыки колориметрического определения ионов магния в растворе. Оборудование. ФЭК любой марки, аналитические весы, мерные колбы вместимостью 100 мл, пипетки. Реактивы. Раствор эриохрома черного Т с массовой долей 0, 1 % в метаноле. Растворяют при нагревании и полученный раствор фильтруют. Буферный раствор с рН 10, 2.В100мл1М раствора аммиака растворяют 0, 75 г хлорида аммония. Стандартный раствор сульфата магния. Выполнение работы. В мерную колбу вместимостью 100 мл помещают 0, 5 мл анализируемого раствора, добавляют 25 мл буферного раствора, разбавляют водой и перемешивают. Затем приливают 10 мл раствора эриохрома черного Т, перемешивают и разбавляют водой до метки. Полученный раствор опять перемешивают и сразу измеряют оптическую плотность раствора по отношению к раствору сравнения при 520 нм. В качестве раствора сравнения используют те же растворы, что и в анализируемом растворе. Для построения градуировочного графика 1, 0141 г х.ч. MgSO4 • 7Н2О растворяют в воде в мерной колбе вместимостью 1л. В 1 мл приготовленного стандартного раствора содержится 100 мкг ионов магния. Этот раствор используют для построения градуировочного графика. С этой целью стандартный раствор сульфата магния объемом 0, 1; 0, 2; 0, 3; 0, 4; 0, 5; 0, 6; 0, 7; 0, 8; 0, 9 мл, содержащий соответственно 10, 20, 30, 40, 50, 60, 70, 80, 90 мкг, вносят в мерную колбу вместимостью 100 мл и обрабатывают также, как и анализируемый раствор. В анализируемом растворе содержание ионов магния не должно превышать 100 мкг.
Лабораторная работа 6. Фотоколориметрическое определение редуцирующих Сахаров в растворе. Определение основано на том, что глюкоза, галактоза, арабиноза и другие сахара восстанавливают в щелочной среде гексацианоферрат (III) калия K3[Fe(CN)6] в гексацианоферрат (II) калия K4[Fe(CN)6]. Содержание сахара определяют или по количеству выделившегося K4[Fe(CN)6] или же по избытку непрореагировавшего K3[Fe(CN)6]. Метод используют при определении больших концентраций Сахаров (например, содержание глюкозы в пробе составляет 15-20 мг) в кондитерских и хлебо-булочных изделиях, напитках и овощных консервах. Цель работы. Приобрести навыки колориметрического определения сахаров. Оборудование. ФЭК любой марки, водяная баня, конические колбы, бюретки, мерные цилиндры, песочные часы (1 мин). Реактивы. Стандартный раствор глюкозы. 1, 09 г чистой кристаллической глюкозы растворяют в мерной колбе вместимостью 500 мл. 1 мл такого раствора содержит 2 мг глюкозы. Раствор K3[Fe(CN)6] готовят растворением 10 г этой соли в 1 л воды Раствор гидроксида калия с концентрацией 1, 25 моль/л. Выполнение работы. В коническую колбу вносят 20 мл раствора K3[Fe(CN)6], 10 мл раствора гидроксида калия и 10 мл анализируемого раствора. Раствор кипятят на водяной бане 1 мин, охлаждают и измеряют оптическую плотность при 400-440 нм в кювете с толщиной слоя 10 мм. Поглощение раствора обусловлено непрореагировавшим избытком K3[Fe(CN)6]. В качестве раствора сравнения служит вода. Для построения градуировочного графика в 7 конических колб вносят по 20 мл раствора K3[Fe(CN)6], 10 мл раствора КОН и определенные объемы раствора глюкозы (6, 5; 7, 0; 7, 5; 8, 0; 8, 5; 9, 0; 9, 5 мл). В каждой колбе объем доводят водой до 40 мл. Реакция между глюкозой и K3[Fe(CN)6] протекает не строго стехиометрически, поэтому градуировочный график непрямолинеен. Определение аммиака. Обнаружение аммиака в воде свидетельствует о том, что вода является непригодной для питья. Реактив Несслера используют не только для качественного обнаружения аммиака и аммонийных солей, но и для их количественного определения с помощью фотометрических методов анализа. Определение основано на реакции
2K2[HgI4] + 4KOH +NH4Cl → [Hg2ONH2]I↓ + 3Н2О + 7KI + КСl.
Фотометрическое определение аммиака в растворе сопряжено с некоторыми особенностями. Определение аммиака нельзя проводить, если содержание аммиака превышает 5 мг/л, так как в этом случае выпадает красно-коричневый осадок. После приливания реактива Несслера к анализируемому раствору последний при стоянии начинает коагулировать, поэтому сравнение окраски надо проводить до коагуляции. В то же время надо иметь в виду, что реакция солей аммония и аммиака с реактивом Несслера протекает не сразу. Если концентрация аммиака в растворе меньше 5 мг/л, то при приливании реактива Несслера возникает окрашивание раствора от желтого до светло-коричневого. При содержании аммиака 0, 05 мг/л окрашивания не наблюдается. Перед добавлением реактива Несслера в анализируемый раствор приливают раствор сегнетовой соли, которая связывает ионы магния, кальция и железа. Для получения реактива Несслера поступают следующим образом. 32 г йодида ртути (II) HgI2 и 20 г йодида калия KI растворяют в 50 мл воды и доводят объем до 200 мл водой. 20 мл полученного раствора смешивают с 30 мл концентрированного раствора КОН. Реактив хранят в темном месте. Для получения воды, не содержащей аммиака, дистиллированную воду перегоняют вторично в присутствии карбоната натрия. Для приготовления стандартного раствора 0, 3141 г х.ч. хлорида аммония NH4Cl растворяют в мерной колбе вместимостью 1 л в дистиллированной воде, не содержащей аммиака. Приготовленный таким образом раствор содержит 0, 1 мг NH3 в 1 мл раствора или 100 мг в 1 л раствора. Из этого раствора готовят стандартный раствор, для чего 10 мл раствора переносят с помощью пипетки Мора в мерную колбу вместимостью 100 мл и доливают водой до метки. Стандартный раствор содержит 0, 01 мг NH3 в 1 мл раствора или 10 мг в 1 л раствора. Для приготовления раствора сегнетовой соли взвешивают 50 г NaKC4H4O6 • 4Н2О (ч.д.а.) и растворяют в 100 мл нагретой до 40 °С свежеперегнанной воды. Лабораторная работа 1. Определение аммиака в растворе методом стандартного ряда. Цель работы. Приобрести навыки определения аммиака методом стандартного ряда. Оборудование. Колориметрические или простые пробирки, мерные колбы вместимостью 100 мл. Реактивы. 1. Стандартный раствор соли аммония, содержащий 0, 01мг NH3 в 1 мл раствора. 2. Раствор сегнетовой соли. 3. Реактив Несслера. Выполнение работы. В 10 пробирок наливают соответственно 0, 1; 0, 3; 0, 5; 0, 7; 1, 0; 1, 4; 1, 7; 2, 0; 2, 5; 3, 0 мл стандартного раствора и доводят объем в каждой пробирке водой до 20 мл. 10 мл анализируемой воды наливают в пробирку и разбавляют водой до 20 мл. В каждую пробирку стандартного ряда и в пробирку с анализируемым раствором приливают по 0, 5 мл раствора сегнетовой соли, по 1 мл реактива Несслера и перемешивают. Через 5-7 мин после добавления реактивов сравнивают окраску анализируемого раствора с окраской растворов стандартного ряда. Если содержание аммиака в анализируемом растворе больше, чем в стандартном, необходимо раствор предварительно разбавить. С этой целью определенный объем анализируемого раствора помещают в мерную колбу вместимостью 100 мл и разбавляют водой до метки. Раствор тщательно перемешивают. Делают вывод о содержании аммиака в воде. Лабораторная работа 2. Фотоколориметрическое определение аммиака в воде. Цель работы. Приобрести навыки определения аммиака фотоколориметрическим методом. Оборудование. ФЭК любой марки, мерная колба вместимостью 50 мл. Реактивы. См. лабораторную работу 1. Выполнение работы. Определенный объем анализируемого раствора помещают в мерную колбу вместимостью 50 мл и добавляют 0, 5 мл раствора сегнетовой соли. Разбавляют раствор водой, добавляют 1 мл раствора Несслера, приливают воду до метки и перемешивают. Оптическую плотность полученного окрашенного раствора измеряют с синим светофильтром, поместив во вторую кювету дистиллированную воду в качестве раствора сравнения. По градуировочному графику определяют содержание аммиака в воде. Для построения градуировочного графика используют стандартный раствор аммиака, содержащий 0, 01 мг NH3 в 1 мл раствора. Определенные объемы стандартного раствора (табл. 24.2) помещают в мерную колбу вместимостью 50 мл и обрабатывают как анализируемый раствор. Таблица 24.2. Данные к построению градуировочного графика для фотоколориметрического определения содержания аммиака в воде
Делают вывод о качестве воды. Колориметрическое определение рН. Как известно, реакцию среды и рН водных растворов электролитов определяют с помощью индикаторов (гл. 2.1.). Теория кислотно-основных индикаторов изложена в гл. 20.3. Приближенное определение рН анализируемого раствора проводят с помощью универсальной индикаторной бумаги, которая представляет собой смесь индикаторов. Однако колориметрическое определение рН можно проводить безбуферным и буферным методами. Точность этих методов не превышает 0, 1 ед. рН. Наиболее распространенным методом безбуферного определения рН является метод Михаэлиса. Этот метод применяется в микробиологических лабораториях при проверке рН питательных сред, особенно агаровых. Метод Михаэлиса основан на применении стандартных рядов, полученных с одноцветными индикаторами – динитро- и нитрофенолами - в растворах с различными значениями рН (табл. 24.3). Предварительно при помощи универсальной индикаторной бумаги узнают примерное значение рН анализируемого раствора. По этому значению рН выбирают индикатор. Допустим, по универсальной индикаторной бумаге рН анализируемого раствора 3, 0. Следовательно, определение рН раствора надо проводить с индикатором 2, 4-динитрофенолом, интервал перехода окраски которого равен 2, 0 - 4, 7 рН (см. табл. 24.3). Таблица 24.3. Одноцветные индикаторы, предложенные Михаэлисом
В пробирку наливают 3 мл анализируемого раствора, добавляют 0, 5 мл выбранного индикатора и перемешивают. Окраску анализируемого раствора сравнивают с растворами этого индикатора с промежуточными значениями рН в интервале 2, 0-4, 7.Совпадение окраски анализируемого раствора и одного из стандартных растворов указывает на то, что в обоих растворах одинаковое значение рН. При отсутствии стандартных растворов выбранного индикатора их готовят самостоятельно. Буферный метод основан на сравнении окраски индикатора в анализируемом растворе и в стандартных буферных растворах с известными величинами рН, к которым добавлен тот же индикатор и в том же количестве.
Лабораторная работа. Колориметрическое определение рН буферным методом. Цель работы. Приобрести навыки определения рН буферным методом. Оборудование. Пробирки одинакового диаметра. Реактивы. Буферные растворы, выбранный индикатор. Выполнение работы. Определяют приближенное значение рН анализируемого раствора по универсальной индикаторной бумаге. С этой целью каплю анализируемого раствора наносят на полоску индикаторной бумаги и сравнивают окраску пятна на индикаторной бумаге с окраской цветной шкалы рН, прилагаемой к индикаторной бумаге. Затем по ориентировочному значению рН выбирают индикатор и состав буферного раствора (ацетатный, фосфатный) для данной области рН. Например, ориентировочное значение рН равно 4. Тогда для точного определения рН готовят серию ацетатных буферных растворов (табл. 24.4), рН которых отличаются друг от друга примерно на 0, 2 единицы и охватывают область приближенного значения рН. В данном случае для точного определения рН готовят по 10 мл ацетатных буферных растворов с рН 3, 80; 4, 15; 4, 39; 4, 58. Приготовленные буферные растворы помещают в пронумерованные пробирки и прибавляют в каждую пробирку по 3 капли индикатора метилоранжа. Растворы тщательно перемешивают. В отдельную пробирку такого же диаметра приливают 10 мл анализируемого раствора, добавляют 3 капли индикатора метилоранжа и перемешивают. Сравнивают окраску анализируемого раствора с окраской буферных растворов на фоне белой бумаги. Значение рН анализируемого раствора равно рН того буферного раствора, окраска которого совпадает с окраской анализируемого. Если окраска анализируемого раствора лежит между окраской двух соседних буферных растворов, например с рН 4, 15 и рН 4, 39, то искомое значение рН раствора будет 4, 27. Таблица 24.4. Приготовление буферных растворов для определения рН
* Примечание. 1.Ацетатный буфер: 0, 1М раствор СН3СООН (А); 0, 1М раствор CH3COONa (В). 2. Фосфатный буфер: 0, 1М раствор NaH2PO4 (A); 0, 1М раствор Na2HPO4 (В). Делают вывод о значении рН анализируемого раствора.
|