Кратные связи. s- и p-связи
Единичная химическая связь представляет собой общую электронную пару, локализованную в области перекрывания валентных атомных орбиталей, что приводит к образованию области повышенной электронной плотности, расположенной между ядрами атомов. Если область повышенной электронной плотности располагается симметрично линии, проходящей через ядра взаимодействующих атомов (линии связи), то такой тип связи называется s-связью. Она принципиально может образовываться в результате перекрывания любого типа атомных орбиталей (рис. 2.5).
H2 (H 1 s 1)
Cl2 (Cl 3 s 23 p 5)
HF (H1 s 1; F 2 s 22 p 5)
Рис. 2.5. Схема образования s-связи
Примечание. Волновые функции, описывающие атомные орбитали, могут иметь области положительных и отрицательных значений – знак функции. Функция, описывающая s -орбиталь, во всей области пространства положительна (рис. 2.6, а). Функции, описывающие p - и d - орбитали, имеют узловые точки (точки в которых функция обращается в ноль). При переходе через узловую точку волновая функция меняет свой знак на противоположный, то есть имеются области орбиталей с отрицательным и положительным знаком волновых функций (рис. 2.6, б, в). Область повышенной электронной плотности (образование связи) возникает в том случае, если перекрываются электронные орбитали, функции которых имеют одинаковый знак. Поэтому, например, перекрывание s и py или pz (направление оси x совпадает с линией связи) не приводит к образованию химической связи (рис. 2.6, г). Связь образуется при перекрывании s- и положительной части px -орбиталей (рис. 2.6, д).
Рис. 2.6. Области орбиталей с отрицательным и положительным знаком волновых функций
Поскольку s-связь обладает цилиндрической симметрией, то поворот атомов относительно друг друга вокруг линии связи не приводит к изменению распределения электронной плотности. Поэтому оба атома могут свободно вращаться вокруг оси, совпадающей с линией связи, не разрывая и не деформируя s-связь. Электроны, имеющие сложную симметрию орбиталей (p - и d -орбитали), могут образовывать связь в результате перекрывания орбиталей в двух областях над и под линией связи. Такой тип связи называется p-связью (рис. 2.7). Энергия p-связи меньше, чем энергия s-связи, так как перекрывание орбиталей по p-типу меньше, чем по s-типу. p-связь не обладает цилиндрической симметрией относительно линии связи, поэтому вращение атомов вокруг линии связи исключено, что объясняет существование цис- и транс-изомеров.
Рис. 2.7. Схема образования p-связи
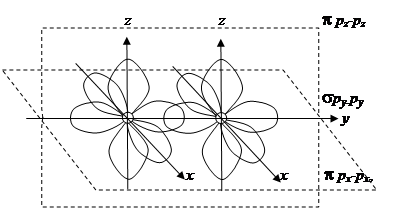
При образовании химической связи между двумя атомами в первую очередь образуется s-связь. Во многих случаях она будет единственной, но если атомы имеют дополнительно неспаренные р -электроны, то кроме s-связи может образоваться одна или две p-связи, которые будут располагаться во взаимно перпендикулярных плоскостях. В этом случае говорят о кратности связи – двойная связь (s- и одна p-связь) или тройная связь (s- и две p-связи), которые образованны соответственно двумя или тремя электронными парами (рис. 2.8).
Рис. 2.8. Схема образования кратных связей: py-py – одна s-связь, px-px, pz-pz – две p-связи
С увеличением кратности связи увеличивается энергия связи и уменьшается ее длина. Пример. Характеристики химических связей различной кратности:
|