Геометрия простейших молекул. Гибридизация АО
Вследствие того, что общая электронная пара локализована в области перекрывания атомных орбиталей, взаимное расположение атомов в молекуле будет определяться пространственной ориентацией валентных орбиталей. Рассмотрим, например, пространственное строение молекул, образованных двумя атомами водорода и атомом халькогена (H2O, H2S, H2Se). В атомах водорода валентным является s-электрон (H 1 s 1), а в атомах халькогенов два неспаренных p-электрона (O, S, Se - ns 2 npx 2 py 1 pz 1). Атом халькогена в этих молекулах образует две s-связи с атомами водорода в результате перекрывания py - и pz -орбиталей с s -орбиталями. py - и pz -орбитали располагаются относительно друг друга под углом 90о, поэтому угол связи (валентный угол) должен быть равен этой величине (рис.2.9).
Рис. 2.9. Схема перекрывания атомных орбиталей в молекуле халькогенводорода
В то же время величина валентного угла зависит также от электростатического взаимодействия зарядов, возникающих на атомах молекулы в результате поляризации связи. На атомах водорода возникает эффективный положительный заряд d+, величина которого прямо пропорциональна электроотрицательности халькогенов. Электростатическое взаимодействие атомов водорода приводит к увеличению угла связи, причем тем больше, чем больше d+. Следовательно, максимальное отклонение валентного угла от 90о должно быть в молекуле H2O, а минимальное – в молекуле H2Se. Экспериментально полученные величины валентных углов в этих молекулах и электроотрицательности халькогенов представлены ниже:
В ряде случаев описание химической связи в молекулах с использованием «обычных» атомных орбиталей вступало в противоречие с экспериментальными данными. Например, в молекуле BeH2 атом бериллия на внешнем уровне имеет два спаренных s -электрона (2 s 2). Для образования связи с двумя атомами водорода атом бериллия должен иметь два неспаренных электрона. Это возможно при переходе одного электрона на p -орбиталь (возбужденное состояние – 2 s 12 px 1). В этом случае в молекуле BeH2 связи между атомами бериллия и водорода должны быть разными (s s-s и s s-p). Эксперимент показывает, что в химическом плане оба атома водорода равноценны, то есть химические связи между атомами водорода и бериллия одинаковы. Такого рода противоречия были разрешены с развитием Полингом (Pauling) и Слэтером (Slater) теории гибридизации атомных орбиталей. Было показано, что если в образовании атомом химической связи принимают участие орбитали различной симметрии, не сильно различающиеся по энергии, то при описании химической связи они могут быть заменены таким же числом равноценных гибридных орбиталей. При построении гибридных волновых функций выполняются следующие правила: 1. Волновая функция, описывающая гибридную орбиталь, представляет собой сумму исходных атомных волновых функций с учетом их вклада:
Гибридные орбитали имеют определенную пространственную конфигурацию, отличную от атомных (рис. 2.10). Рис. 2.10. Схема образования sp - и pd -гибридных орбиталей 2. Энергия всех гибридных орбиталей одинакова. Их суммарная энергия меньше, чем суммарная энергия исходных атомных орбиталей. При гибридизации энергия системы понижается. 3. Число гибридных орбиталей равно числу исходных атомных орбиталей. Максимальное число гибридных орбиталей с участием s, p и d- электронов не может быть больше шести. 4. При образовании химической связи возможны случаи, когда гибридизуются не все валентные электроны. Как правило, гибридные орбитали образуют s-связи и в основном определяют пространственную ориентацию соседних атомов (геометрию молекулы), а негибридизовавшиеся орбитали могут образовывать дополнительные связи (например, p-связи). Примеры различных случаев гибридизации.
1. sp -гибридизация: одна s - и одна p -орбиталь образуют две гибридные sp -орбитали, обладающие линейной симметрией: Пример. Молекула BeH2 (Be - 2s2; Be* - 2s12px1; H - 1s1) линейна, все три атома лежат на прямой, атом бериллия в центре. Он образует две s-связи с двумя атомами водорода в результате перекрывания двух sp -гибридных орбиталей с s -орбиталями атомов водорода (рис. 2.11).
Рис. 2.11. Схема образования связи в молекуле BeH2
2. sp 2-гибридизация: одна s - и две p -орбитали (px py) образуют три sp 2-гибридные орбитали, лежащие в одной плоскости и направленные относительно друг друга под углом 120о. Пример. Молекула BF3 (B 2 s 22 px 1; B*2 s 12 px 12 py 1; F 2 s 22 p 5) представляет собой плоский равносторонний треугольник с атомом бора в центре и тремя атомами фтора в вершинах. Атом бора образует три s-связи с тремя атомами фтора в результате перекрывания трех sp 2-гибридных орбиталей с p -орбиталями атомов фтора, на которых находятся неспаренные электроны (рис. 2.12).
Рис. 2.12. Схема образования связи в молекуле BF3
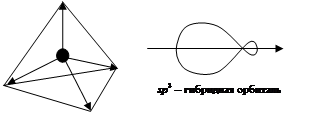
3. sp 3-гибридизация: одна s - и три p -орбитали образуют четыре sp 3-гибридные орбитали, направленные в вершины тетраэдра (многогранник, образованный четырьмя равносторонними треугольниками). Угол между осями гибридных орбиталей 109о29' (рис. 2.13):

Рис. 2.13. Схема ориентации в пространстве четырех sp 3-гибридных орбиталей
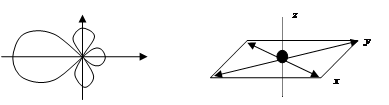
Пример. Молекула CH4 (C 2 s 22 px 12 py 1; C* 2 s 12 px 12 py 12 pz 1; H1 s 1) – тетраэдр, в центре которого располагается атом углерода, а в вершинах четыре атома водорода. 4. dsp 2-гибридизация: одна s -, одна d - и две p -орбитали образуют четыре dsp 2-гибридные орбитали, лежащие в одной плоскости, направленные относительно друг друга под углом 90о (рис. 2.14):

Рис. 2.14. Схема ориентации в пространстве четырех dsp 2-гибридных орбиталей
Пример. Ион [CuCl4]-2 представляет собой плоский квадрат, в центре которого находится ион Cu+2, в вершинах квадрата – четыре иона Cl-. 5. d 2 sp 3-гибридизация: одна s -, две d - и три p -орбитали образуют шесть d 2 sp 3-гибридных орбиталей, направленные в вершины октаэдра (многогранник, образованный восьмью равносторонними треугольниками)
Пример. Ион [PtCl6]-2 представляет собой плоский квадрат, в центре которого находится ион Pt+4, в вершинах квадрата четыре иона Cl-, над и под плоскостью квадрата располагаются еще два иона Cl- (октаэдр, в вершинах которого располагаются ионы хлора, а в центре ион платины). Расстояние между ионом платины и всеми ионами хлора одинаково. Валентные углы равны 90о (рис. 2.15).
Рис. 2.15. Схема ориентации в пространстве шести d 2 sp 3-гибридных орбиталей
|


 , где сi – нормирующие множители, учитывающие вклад каждой атомной орбитали.
, где сi – нормирующие множители, учитывающие вклад каждой атомной орбитали.
 .
.

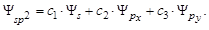
 .
.



