Ковалентные (атомные) кристаллы
Ковалентные кристаллы образуют атомы с равной или близкой электроотрицательностью. Связь между атомами в решетке осуществляется за счет ковалентной связи, поэтому число ближайших соседей в решетке определяется валентностью атома (числом общих электронных пар с соседними атомами). Взаимное расположение ближайших соседних атомов определяется направленностью в пространстве валентных орбиталей. В случае ковалентных кристаллов координационное число равно числу ковалентных связей атома в узле кристаллической решетки. Пример. Кристалл, образованный атомами углерода, имеющего четыре валентных электрона (C-2 s 22 p 2). В случае sp 3-гибридизации четыре гибридные орбитали образуют тетраэдрическую структуру, пространственное повторение которой дает решетку алмаза. Каждый атом углерода связан с четырьмя соседними атомами равноценными связями ( Как известно, углерод имеет несколько полиморфных (аллотропических) модификаций: алмаз, графит, карбин (нитевидный углерод), фуллерены. Кристаллическая решетка алмаза, как было показано выше, соответствует полной sp 3-гибридизации валентных электронов. Однако в гибридизации могут участвовать не все валентные электроны. Случаю sp 2-гибридизации соответствует кристаллическая решетка графита. Три гибридные орбитали образуют плоский правильный треугольник, перпендикулярно которому располагается четвертая р -орбиталь. Каждый атом углерода связан с тремя соседями равноценными s-связями, образованными sp 2-гибридными электронами. В результате в плоскости образуется гексагональная сетка ( Случаю sp -гибридизации соответствует кристаллическая решетка карбина.
|

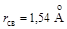 ), угол между которыми составляет ~109o. Алмазоподобную решетку имеют также и изоэлектронные углероду атомы кремния (Si-3 s 23 p 2), германия (Ge-4 s 24 p 2). Алмазоподобную решетку образуют также изоэлектронные молекулы (суммарное число валентных электронов такое же как и у двух атомов углерода). Например, нитрид бора (боразон) [B 2 s 22 p 1 N 2 s 22 p 3], арсенид галлия [Ga 4 s 24 p 1 As 4 s 24 p 3], карбид кремния (карборунд) [C 2 s 22 p 2 Si 3 s 23 p 2]. Необходимо отметить, что в нитриде бора и арсениде галлия четвертая ковалентная связь образуется по донорно-акцепторному механизму.
), угол между которыми составляет ~109o. Алмазоподобную решетку имеют также и изоэлектронные углероду атомы кремния (Si-3 s 23 p 2), германия (Ge-4 s 24 p 2). Алмазоподобную решетку образуют также изоэлектронные молекулы (суммарное число валентных электронов такое же как и у двух атомов углерода). Например, нитрид бора (боразон) [B 2 s 22 p 1 N 2 s 22 p 3], арсенид галлия [Ga 4 s 24 p 1 As 4 s 24 p 3], карбид кремния (карборунд) [C 2 s 22 p 2 Si 3 s 23 p 2]. Необходимо отметить, что в нитриде бора и арсениде галлия четвертая ковалентная связь образуется по донорно-акцепторному механизму. ) связанных между собой атомов углерода. Отдельные плоскости связаны между собой более слабой связью (
) связанных между собой атомов углерода. Отдельные плоскости связаны между собой более слабой связью ( ) за счет негибридизованных p -электронов. Кристаллическая решетка представляет собой набор параллельных, относительно слабо связанных между собой плоскостей.
) за счет негибридизованных p -электронов. Кристаллическая решетка представляет собой набор параллельных, относительно слабо связанных между собой плоскостей.


