Тема: Теория электролитической диссоциации. Окислительно-восстановительные реакции
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты -проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Схема электролитической диссоциации.
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко. Сила электролитов. Силу электролитов можно охарактеризовать с помощью степени диссоциации.
Степень диссоциации потенциальных электролитов изменяется в пределах 0< α ≤ 1(значение α =0 относится к неэлектролитам).
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Степень окисления Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные. Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например: N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3. Расчет степени окисления Для вычисления степени окисления элемента следует учитывать следующие положения: 1. Степени окисления атомов в простых веществах равны нулю (Na0; H20). 2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона. 3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1). 4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры: V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2 Реакции без и с изменением степени окисления Существует два типа химических реакций: A Реакции, в которых не изменяется степень окисления элементов: Реакции присоединения SO2 + Na2O Na2SO3 Реакции разложения Cu(OH)2 –t CuO + H2O Реакции обмена AgNO3 + KCl AgCl + KNO3 NaOH + HNO3 NaNO3 + H2O B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений: 2Mg0 + O20 2Mg+2O-2 2KCl+5O3-2 –t 2KCl-1 + 3O20 2KI-1 + Cl20 2KCl-1 + I20 Mn+4O2 + 4HCl-1 Mn+2Cl2 + Cl20 + 2H2O Такие реакции называются окислительно - восстановительными. Окисление, восстановление В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается: H20 - 2ē 2H+ S-2 - 2ē S0 Al0 - 3ē Al+3 Fe+2 - ē Fe+3 2Br - - 2ē Br20 Процесс присоединения электронов - восстановление: При восстановлении степень окисления понижается. Mn+4 + 2ē Mn+2 S0 + 2ē S-2 Cr+6 +3ē Cr+3 Cl20 +2ē 2Cl- O20 + 4ē 2O-2 Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями. Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Важнейшие восстановители и окислители
Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами: S0 + O20 S+4O2-2
S - восстановитель; O2 - окислитель Cu+2O + C+2O Cu0 + C+4O2 CO - восстановитель; CuO - окислитель Zn0 + 2HCl Zn+2Cl2 + H20 Zn - восстановитель; HСl - окислитель Mn+4O2 + 2KI-1 + 2H2SO4 I20 + K2SO4 + Mn+2SO4 + 2H2O KI - восстановитель; MnO2 - окислитель. Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления 2H2S-2 + H2S+4O3 3S0 + 3H2O Внутримолекулярные окислительно- восстановительные реакции Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель. 2KCl+5O3-2 2KCl-1 + 3O20 Cl+5 - окислитель; О-2 - восстановитель N-3H4N+5O3 –t N2+1O + 2H2O N+5 - окислитель; N-3 - восстановитель 2Pb(N+5O3-2)2 2PbO + 4N+4O2 + O20 N+5 - окислитель; O-2 - восстановитель Опыт. Разложение дихромата аммония (N-3H4)2Cr2+6O7 –t Cr2+3O3 + N20 + 4H2O Cr+6 - окислитель; N-3 - восстановитель. Диспропорционирование- окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH KCl+1O + KCl-1 + H2O 3K2Mn+6O4 + 2H2O 2KMn+7O4 + Mn+4O2 + 4KOH 3HN+3O2 HN+5O3 + 2N+2O + H2O 2N+4O2 + 2KOH KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных реакций A Электронный баланс- метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем . Уравнение составляется в несколько стадий: 1. Записывают схему реакции. KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O 2. Проставляют степени окисления над знаками элементов, которые меняются. KMn+7O4 + HCl-1 KCl + Mn+2Cl2 + Cl20 + H2O 3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем. Mn+7 + 5ē Mn+2 2Cl-1 - 2ē Cl20 4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
–––––––––––––––––––––––– 2Mn+7 + 10Cl-1 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды:
–––––––––––––––––––––––––––––––––––––– 10Cl- + 2MnO41- + 16H+ 5Cl20 + 2Mn2+ + 8H2O (для уравнивания ионной полуреакции используют H+, OH- или воду) Типичные реакции окисления-восстановления Реакции с участием перманганата калия в качестве окислителя При взаимодействии перманганата калия с восстановителем образуются различные продукты восстановления в зависимости от pH среды. Реакции в кислой среде. 5K2S+4O3 + 2KMn+7O4 + 3H2SO4 6K2S+6O4 + 2Mn+2SO4 + 3H2O электронный баланс
метод полуреакций
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4- + 16H+ + 5SO32- + 5H2O 2Mn2+ + 8H2O + 5SO42- + 10H+ или 2MnO4- + 6H+ + 5SO32- 2Mn2+ + 3H2O + 5SO42-
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O 3K2S+6O4 +2Mn+4O2 + 2KOH
электронный баланс
метод полуреакций:
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4- + 4H2O + 3SO32- + 6OH- 2MnO2 + 8OH- + 3SO42- + 3H2O или 2MnO4- + H2O + 3SO32- 2MnO2 + 2OH- + 3SO42- Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка. Реакции в щелочной среде. K2S+4O3 + 2KMn+7O4 + 2KOH K2S+6O4 +2K2Mn+6O4 + H2O
электронный баланс
метод полуреакций:
––––––––––––––––––––––––––––––––––––– SO32- + 2OH- + 2MnO4- SO42- + H2O + 2MnO42- Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4. Таким образом,
Реакции с дихроматом калия в качестве окислителя Степень окисления хрома понижается с +6 до +3. Наблюдается изменение окраски реакционной массы с желто-оранжевого цвета до зеленого или фиолетового. 1) K2Cr2+6O7 + 3H2S-2 + 4H2SO4 K2SO4 + Cr2+3(SO4)3 + 3S0 + 7H2O 2) электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––– Cr2O72- + 8H+ + 3H2S 2Cr3+ + 7H2O + 3S0 2) K2Cr2+6O7 + 6Fe+2SO4 + 7H2SO4 3Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)3 + 7H2O электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––––– 6Fe2+ + Cr2O72- + 14H+ 2Cr3+ + 6Fe3+ + 7H2O 3) K2Cr2+6O7 + 14HCl-1 3Cl20 + 2KCl + 2Cr+3Cl3 + 7H2O электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––– Cr2O72- + 6Cl- + 14H+ 2Cr3+ + 3Cl20 + 7H2O Окислительные свойства азотной кислоты Окислителем в молекуле (см. также " Азотная кислота") азотной кислоты является N+5, который в зависимости от концентрации HNO3 и силы восстановителя (например, активности металла - см. также тему " Азотная кислота") принимает от 1 до 8 электронов, образуя 1) Cu0 + 4HN+5O3(конц.) Cu+2(NO3)2 + 2N+4O2 + 2H2O электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––– Cu0 + 2NO3- + 4H+ Cu2+ + 2NO2 + 2H2O 2) 3Ag0 + 4HN+5O3(конц.) 3Ag+1NO3 + N+2O + 2H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––– 3Ag0 + NO3- + 4H+ 3Ag+ + NO + 2H2O 3) 5Co0 + 12HN+5O3(разб.) 5Co+2(NO3)2 + N20 + 6H2O электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––– 5Co0 + 2NO3- + 12H+ 5Co2+ + N2 + 6H2O 4) 4Ca0 + 10HN+5O3(оч.разб.) 4Ca+2(NO3)2 + N-3H4NO3 + 3H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––– 4Ca0 + NO3- + 10H+ 4Ca2+ + NH4+ + 3H2O При взаимодействии HNO3 с неметаллами выделяется, как правило, NO: 1) 3C0 + 4HN+5O3 3C+4O2 + 4N+2O + 2H2O электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––––––––––––– 3C0 + 6H2O + 4NO3- + 16H+ 3CO2 + 12H+ + 4NO + 8H2O или 3C0 + 4NO3- + 4H+ 3CO2 + 4NO + 2H2O 2) 3P0 + 5HN+5O3 + 2H2O 3H3P+5O4 + 5N+2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––––––––––––––– 3P0 + 12H2O + 5NO3- + 20H+ 3PO43- + 24H+ + 5NO + 10H2O или 3P0 + 2H2O + 5NO3- 3PO43- + 4H+ + 5NO Пероксид водорода в окислительно-восстановительных реакциях 1. Обычно пероксид водорода используют как окислитель: H2O2 + 2HI-1 I20 + 2H2O электронный баланс:
метод полуреакций:
–––––––––––––––––––––– 2I- + H2O2 + 2H+ I2 + 2H2O При действии сильных окислителей пероксид водорода может окисляться, образуя кислород и воду.
5H2O2 + 2KMn+7O4 + 3H2SO4 5O20 + K2SO4 + 2Mn2+SO4 + 8H2O электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––––––––– 2MnO4- + 5H2O2 + 16H+ 2Mn2+ + 8H2O + 5O2 + 10H+ или 2MnO4- + 5H2O2 + 6H+ 2Mn2+ + 8H2O + 5O2
Раздел 2 Неметаллические элементы и их соединения.
|

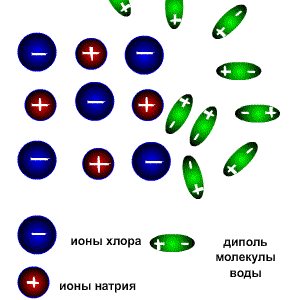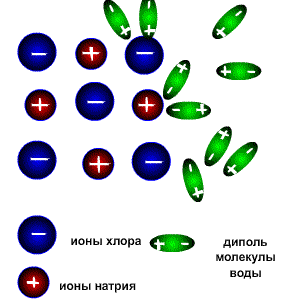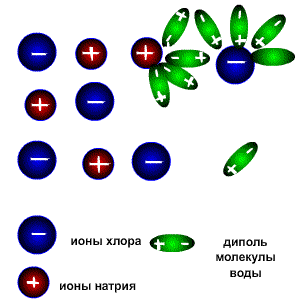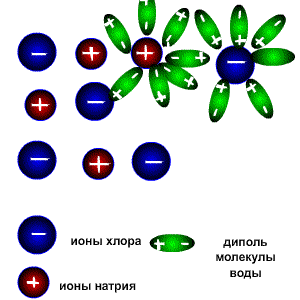
 Na+ + Cl-
Na+ + Cl-





