Строение молекул и ионов
Наиболее вероятная конфигурация молекулы или иона соответствует наименьшему отталкиванию электронных пар или их максимальному удалению друг от друга. Модель отталкивания электронных пар валентной оболочки (ОЭПВО) коротко сводится к следующему. Пространственное распределение химических связей вокруг поливалентных атомов определяется общим числом пар электронов: связывающих и неподеленных. Тип молекулы в общем виде записывается как ABmEn, где А – центральный атом, В – лиганд, Е – неподеленная пара электронов. Геометрия молекулы определяется только числом σ -связей и несвязанных электронов, π -связями можно пренебречь. (Несколько более сильное отталкивание между двойными связями по сравнению с одинарными приводит к незначительным изменениям углов и энергий связей). В соответствии с методом валентных связей (использование этого метода приводит к такому же результату, что и использование модели ОЭПВО), пространственная конфигурация молекулы определяется пространственным расположением гибридных орбиталей центрального атома, которые образуются в результате взаимодействия между орбиталями. Для определения типа гибридизации центрального атома надо знать число гибридизующихся орбиталей. Его можно найти, сложив число связывающих и неподеленных электронных пар центрального атома и отняв число π -связей. Например, в ионе
общее число связывающих и неподеленных пар равно 4 + 1 = 5. Отняв число π -связей, получим число гибридизующихся орбиталей: 5 – 1 = 4. Таким образом, тип гибридизации sp3, тип иона AB3E, пространственное расположение электронных пар имеет форму тетраэдра, а сам ион представляет собой тригональную пирамиду:
Ниже приведены некоторые из возможных вариантов
|



 угловое строение
угловое строение

 тригональная пирамида
тригональная пирамида
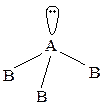 угловое строение
угловое строение

 Т-образное строение
Т-образное строение

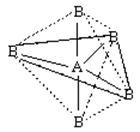
 октаэдр
октаэдр
 тетрагональная пирамида
тетрагональная пирамида
 квадрат
квадрат




