ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Кинетика – учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакции является неравенство Δ Gр, Т < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, Н2(Г) + ½ О2(Г) = Н2О(Г) (1) 2Al(К) + 3 I2(К) = 2 AlI3(К) (2) Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический «тормоз», и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых – концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе. Пример. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) при 850º С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия данной системы: υ пр = К1 [СО][Н2О]; υ обр = К2 [СО2][Н2]; Кравн = В условии задачи даны исходные концентрации, тогда как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]равн = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут: [СО2]равн = [Н2]равн = х моль/л; [СО]равн = (3 – х) моль/л; [Н2О]равн = (2 – х) моль/л. Зная константу равновесия, находим значение, а затем и исходные концентрации всех веществ:
х 2 = 6 – 2 х – 3 х + х 2; 3 х = 6; х = 1, 2 моль/л. Таким образом, искомые равновесные концентрации: [СО2]равн = 1, 2 моль/л; [Н2]равн = 1, 2 моль/л; [СО2]равн = 3 – 1, 2 = 1, 8 моль/л; [Н2О]равн = 2 – 1, 2 = 0, 8 моль/л.
|

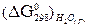 = - 228, 59 кДж/моль, а
= - 228, 59 кДж/моль, а  = - 313, 8 кДж/моль и, следовательно, при Т = 298 К и р = 1 атм возможны реакции, идущие по уравнениям:
= - 313, 8 кДж/моль и, следовательно, при Т = 298 К и р = 1 атм возможны реакции, идущие по уравнениям: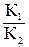 =
=  .
. ;
;


