Задание 13. Осуществить превращения:
Осуществить превращения: 1. NH3 ← N2 → NO → HNO3 → Cu(NO3)2 → Cu(OH)2
Mg3N2 +H2O 2. Са3Р2 → PH3 → P2O5
P2O5 → Н3РО4 → К3РО4 → Ag3PO4
3. K2S → FeS → H2S → S → SO2 → K2SO3 → SO2
4. Сu(NO3)2 → NO2 → HNO3 → Fe(NO3)2 → Fe(OH)2 → FeCl2
5. NaCl → Na → NaOH → Na2CO3 → NaCl → AgCl
6. K2CO3 → CO2 → СаСО3 → СаО → Са(ОН)2 → СаС12
7. Al → Al2O3 → AlCl3 → Al(OH)3 → NaАl(OH)4
Al(NO3)3
8. Mn(OH)2 → MnCl2 → Mn → MnSO4 → Mn(OH)2 → MnO
9. Zn → ZnSO4 → Zn(OH)2 → ZnCl2 → ZnS → H2S
10. NiCl2 → Ni → NiSO4 → Ni(OH)2 → Ni(NO3)2 → NiO.
Задание 14. Составить уравнения окислительно-восстановительных реакций, (подобрать коэффициенты методом электронного и электронно-ионного баланса):
1. Ag + HNO3 → AgNO3 + NO + Н2О
2. Са + H2SO4 → CaSO4 + H2S + Н2О
3. Сu(NО3)2 → CuO + NO2 + О2
4. СrO3 + NH3 → Cr2O3 + N2 + H2O
5. Fe + HNO3 → Fe(NO3)3 + NH4NO3 + H2O
6. Cl2 + KOH → KCl + КСlO + H2O
7. KClO3 + S → KCl + SO2
8. KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O 9. KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + KOH
10. KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O
11. NaI + H2SO4 → I2 + H2S + Na2SO4 + H2O
12. NaCl + MnO2 + H2SO4 → Cl2 + MnSO4 + Na2SO4 + H2O
13. Fe2O3 + CO → FeO + CO2
14. S + KOH → K2S + K2SO3 + H2O
|

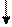

 РСl5 ← Р
РСl5 ← Р



