Гидроксид цинка не взаимодействует
1) с азотной кислотой 2) с гидроксидом калия 3) с соляной кислотой 4) с сульфатом меди (II) 13. При взаимодействии растворов каких двух солей реакция является необратимой? а) Na2SO4 и KCl б) K2SO4 и BaCl2 в) Na2SO4 и NH4Cl г) CH3COONa и Сu(NO3)2 14. Какая кислота образуется при взаимодействии оксида фосфора (III) с водой? а) H3PO4 б) H4P2O7 в) HPO3 г) H3PO3 15. С какими из следующих веществ может взаимодействовать соляная кислота? а) H2O б) BaO в) HNO3 г) BaSO4 16. C какими металлами может взаимодействовать раствор нитрата свинца (II)? а) Hg б) Zn в) Au г) Fe 17. При взаимодействии каких двух веществ происходит реакция нейтрализации? а) Fe2O3 + HCl б) Fe(OH)3 + HCl в) FeCl3 + HSCN г) Fe + HCl 18. Какой соли соответствует название «гидрокарбонат железа (III)»? а) Fe(HCO3)3 б) Fe(HCO3)2 в) FeOHCO3 г) (FeOH)2CO3 19. Какие реакции, протекающие в водном растворе, являются окислительно-восстановительными: а) Al2O3 + HCl б) AlCl3 + H2SO4 в) Al + H2S г) СO2 + КOH. 20. Какие из следующих веществ растворяются в воде? а) AgNO3 б) NaOH в) CuS г) AlPO4 21. Температура замерзания морской воды а) выше, чем температура замерзания чистой воды; 2) ниже, чем температура замерзания чистой воды; 4) равна температуре замерзания чистой воды; 22. Сколько граммов растворенного вещества содержит в 70 г раствора с массовой долей ω % веществава = 10%? а) 10 г б) 20 г в) 7 г)70 г 23. В каких случаях возможно самопроизвольное протекание химической реакции в стандартных условиях: а) Δ Н° > 0, Δ S° < 0; б) Δ Н° < 0, Δ S° > 0; в) Δ Н° = 0, Δ S° < 0; г) Δ Н° > 0, Δ S° = 0. 24. Почему при синтезе аммиака повышают температуру процесса? а) для смещения равновесия вправо; б) для повышения скорости реакции; в) для снижения энергии активации; г) для увеличения выхода продукта. 25. Куда сместится равновесие в системе: С (тв.) + Н2О → Н2 + СО2, Δ Н = 131, 4 кДж при повышении давления? а) равновесие не изменится; б) сместится вправо; в) сместится влево; г) это зависит от теплового эффекта.
Ключ к правильным ответам
Модуль 1-2. «Общая и неорганическая химия» Вариант 1.
а) -1, б) 0, в) +1, г) +2.
а) Δ Н° > 0, Δ S° < 0; б) Δ Н° < 0, Δ S° > 0; в) Δ Н° = 0, Δ S° < 0; г) Δ Н° > 0, Δ S° = 0.
2SO2 + О2 → 2SO3, Δ Н = -192кДж а) сместится вправо; б) не нарушится; в) равновесие в газовых системах зависит только от давления; г) сместится влево.
1) Cr(OH)3, 2) Mg(OH)2, 3) CuОН, 4) Cu(OH)2: а) 3, б) 4, в) 1, г) 2. Вариант 2.
а) Fe2O3 + HCl; б) FeCl3 + H2S; в) Fe + HCl; г) SO2 + NaOH.
Δ Н = -58, 03 кДж/моль и Δ S = -176, 52 Дж/моль К. При какой температуре К наиболее вероятна димеризация? а) 373; б) 273; в) 473; г) 263.
N2 + 3Н2 → 2NH3 Δ Н = -92кДж. а) сместится влево; б) сместится вправо; в) давление не влияет на равновесие, т.к. в данном случае Н < 0; г) возрастет скорость реакции.
1) HNO3; 2) КNО3; 3) НСl; 4) NaCl. а) 3; б) 1; в) 4; г) 2. Вариант 3.
а) CrO42-; б) [Cr(OH)4]-; в) Cr(OH)3; г) Сг3+.
H2S + 3/2 О2 = H2O+ SO2; Δ Н =-518, 59 кДж; S + О2 = SO2 ; Δ Н = -296, 90 кДж; Н2 + 1/2 О2 = Н2О; Δ Н = -241, 84 кДж. а) -20, 15; б) -64, 18; в) -1057, 3; г) 1101, 31.
2SO2 + О2 → 2SO3, Δ Н = -192 кДж, если при T = const увеличить давление в три раза? а) увеличится в 3 раза; б) не изменится; в) увеличится в 27 раз; г) уменьшится в 27 раз.
1) [H+] = 10-7 моль/л; 2) [ОН-] = 5, 10-8; 3) [ОН-] = 10-4; 4) [ОН-] = 5, 10-10. а) 2; б) 1; в) 4; г) 3.
Вариант 4.
а) СrО2-; б) NO; в) AsO33-; г) Н+.
Мg + СО2 = СО + МgО, пользуясь справочными данными. а) -318, 24 и 311, 7; б) 318, 24 и -311, 7; в) -318, 24 и -311, 7; г) 318, 24 и 311, 7.
если увеличить концентрации исходных веществ: а) не изменится, б) сместится вправо; в) это зависит от знака Q; г) сместится влево.
а) 9, 8; б) 4, 9; в) 9, 6; г) 4, 8. Вариант 5.
а) МnО(ОН)2; б) Мn2+; в) MnO2; г) MnO42-.
Ответ подтвердите расчетом, пользуясь справочными данными. а) да; -169, 9; б) нет, +169, 9; в) да, + 169, 9; г) нет, -169, 9.
а) для смещения равновесия вправо; б) для повышения скорости реакции; в) для снижения энергии активации; г) для увеличения выхода продукта.
а) 5 л; б) 15 л; в) 10 л; г) 25л. Вариант 6.
а) Р → Н РО2; б) КМnО4 → MnО2; в) НNО3 → NO2; д) Сl2О → КС1.
а) -857, 7; б) 205, 9; в) 857, 9; г) -205, 9.
3 NO2 + Н2О → 3 HNO3 + NO - 138 кДж, если повысить температуру на 10̊ С? а) сместится вправо; б) не изменится, но скорость возрастет в 2 раза; в) сместится влево; г) не изменится, но скорость возрастет в γ раз.
а) 106; б) 26.5; в) 84; г) 53. Вариант 7.
Fe + H2SO4 (разбавл.) а) H2S; б) Н2; в) SO2; г) S.
а) 679, 48; б) 2271; в) 2123, 0; г) 726, 6.
3NO2 + H2О → 3HNO3 + NO - 138 кДж а) сместится влево; б) не нарушится; в) возрастет только скорость процесса; г) сместится вправо
а) 9, 8; б) 9, 5; в) 4, 25; г) 4, 9. Вариант 8.
Sb2O5 + НCl → Н3SbCl6 + Cl2 + H2O и подсчитайте сумму всех коэффициентов. а) 9; б) 17; в) 26; г) 29.
CH3OH + CH3COOH ----> CH3COOCH3 + H2O, если энтальпии сгорания спирта, кислоты и эфира соответственно равны: - 1366, 91, - 873, 79, и – 2254.21 кДж/моль. а) – 299, 4; б) 13, 5; в) 299, 4; г) -13, 5.
2 SO2 + O2 → 2 SO3, Δ Н = - 192 кДж, если при Т = const увеличить давление в 2 раза? а) увеличится в 8 раз; б) уменьшится в 2 раза; в) уменьшится в 8 раз; г) увеличится в 2 раза.
а) 24; б) 12; в) 1, 204; г) 12, 04.
Вариант 9.
а) - 2; б) - 4; в) 0; г) + 4.
а) работа расширения; б) теплота, передаваемая через изменение микросостояния; в) теплота, передаваемая через изменение макросостояния; г) внутренняя энергия.
а) 1%; б) 10%; в) 10, 10%; г) 50%.
а) 5, 5 л; б) 12 л; в) 10 л; г) 1, 2 л. Вариант 10.
а) Fe2O3 + H2SO4; б) Сl2 + КОН; в) SO2 + NaOH; г) HgO + HNO3;
а) КОН и Са (ОН)2; б) Са (ОН)2 и Сu (ОН) 2; в) А1 (ОН)3 и Ca (OH) 22; г) КОН и Сu (ОН) 2.
N2 + 3 H2 → 2NH3 Δ H = - 92кДж? если равновесные концентрации равны: [ N2 ] = 0, 9; [ Н2 ] = 0, 6 и [ NH3 ] = 6 моль/л а) увеличится в 1, 8 раза; б) уменьшится в 1, 8 раза; в) уменьшится в 1, 4 раза; г) не изменится.
а) 19, 6; б) 39, 2; в) 40; г) 9.8.
Вариант 11.
а) 4HNO3 → 4 NO2 + 2Н2O + O2; б) 2 KClO3 → КCl + 3O2; в) 4 КС1О4 → 3 KClO3 + КС1; г) 2 НС1О → 2 НС1 + О2.
С + 2 N2O → СО2 + 2 N2; Δ Н° - 556, 61 кДж; C + O2 → CO2; Δ Н° - 393.51 кДж а) 81, 55; б) 326, 2; в) 163, 1; г) – 81, 55.
2SO2 + О2 → 2 SO3, Δ Н = - 192 кДж в результате введения инертного газа при V= const. а) в обратном; б) в прямом; в) не сместится; г) равновесие не изменится.
а) 14, 7; б) 58, 4; в) 12, 5; г) 29, 4. Вариант 12.
а) Н2SO3 → H2SO4; б) Сl2О → НС1; в) Р2О5 → HPO3; г) FeSO4 → Fe2(SO4)3.
НgО + Н2 -----> Нg + Н2О а) - 151, 13 и 15, 3; б) + 151, 13 и 15, 3; в) – 151, 13 и - 64, 02; г) + 151, 13 и 64, 2.
N2 + 3 H2 → 2NH3, Δ Н = - 92 кДж в результате введения инертного газа при V= const. а) не сместится; б) равновесие не изменится; в) в прямом; г) в обратном.
а) 656 мл; б) 1312; в) 1288; г) 644. Вариант 13.
а) J־; б) Сг³ +; в) Cr2O7² ־; г) N2H4;
3 SiO2 + 4 В → 3 Si + 2 В2О2 и определите, возможен ли этот процесс в стандартных условиях. а) - 45, 7; да; б) – 97, 84; да; в) 45, 7 кДж; нет; г) 97, 84; нет.
а) 0, 02; б) 20, 48; в) 40, 96; г) 0, 01.
а) 1990; б) 1903; в) 951, 5; г) 945. Вариант 14.
а) NO2; б) Н2; в) NH4NO3; г) NO.
S (монокл.) + О2 → S О2 + 297, 2 кДж; S (ромбич.) + О2 → S О2 + 296, 9 кДж. а) -594, 1; б) -0, 3; в) 0, 3; г) 594, 1.
а) Δ Н < 0; б) Δ Н = 0; в) Δ Н = 0; г) Δ Н > 0.
перевести в сульфат с помощью 400 мл 2, 5 н раствора NaOH? а) 1310; б) 655; в) 327; г) 565. Вариант 15.
а) СО2; б) СО; в) Н2СО3; г) СН4.
а) 39, 2; б) 400, 3; в) 1675; г) 164.2.
СаСО3 → СаО + СО2 - Q? а) увеличить давление; б) повысить температуру; в) повысить концентрацию СаСОз; г) повысить концентрацию СО2?
а) 250; б) 1000; в) 500; г) 575. Вариант 16.
КМnО4 + K2S + H2O → МnО2 + S + КОН расставьте коэффициенты и укажите их сумму: а) 6; б) 10; в) 20; г) 22.
а) + 890, 31; б) – 890, 31; в) – 74, 88; г) + 74, 88.
при концентрации оксида азота (II) 0, 6 моль/л и кислорода 0.5 моль/л равна 0, 018 моль/(л.мин). Найти константу скорости реакции. а) 0, 1; б) 0, 06; в) 1, 0; г) 1, 2.
а) 1, 554; б) 0, 668; в) 1, 337; г) 0, 337. Вариант 17.
а) Cs; б) Сu; в) Са; г) A1.
а) – 1, 97; б) – 0, 98; в) – 8, 24; г) – 4, 12.
2 NO + О2 → 2NO2, Δ Н = -114, 2 кДж, когда оксида азота (II) станет 0, 04 моль/л, если начальная концентрация оксида азота (II) составляет 0.06, а кислорода – 0, 1 моль/л. а) 0, 09; б) 0, 01; в) 0, 04; г) 0, 02.
а) 0, 322; б) 1, 87; в) 1, 33; г) 0, 643. Вариант 18.
P + J2 + H2O → H3PO3 + HJ и укажите коэффициент перед веществом, которое восстанавливается а) 6; б) 3; в) 2; г) 4.
2А2 (г) + В2 → А22В (ж). Возможно ли протекание этой реакции в стандартных условиях? а) нет, так как Δ S < 0; б) да, при высокой температуре; в) да, при низких температурах; г) да, если Δ Н < 0, и | Δ H |> | TΔ S |
а) 770; б) 970; в) 870; г) 1070.
а) 4, 75 н и 0, 2665 г; б) 3, 75 и 0, 2665; в) 4, 75 и 0, 1337; г) 3, 75 и 0, 1337. Вариант 19.
а) -1; б) 0; в) -2; г) +2.
а) энергия Гиббса увеличивается; б) энтропия уменьшается; в) энергия Гиббса уменьшается; г) если и Δ Н, и Δ S уменьшаются.
а) растворимость повышается; б) не влияет; в) это зависит от давления; г) растворимость понижается.
прибавить к 400 мл 0, 05 н AgNO3 для полного осаждения AgCl? а) 23, 6; б) 11, 8; в) 5, 9; г) 22, 4. Вариант 20.
а) Fe2O3 + HNO3; б) NO2 + SO2; в) SO2 + КОН; г) PbO + HCl (конц.)
а) ВаСО3; б) СаСО3; в) MgCO3; г) ВеСОз.
Δ Н = 131, 4 кДж при повышении давления? а) равновесие не изменится; б) сместится вправо; в) сместится влево; г) это зависит от теплового эффекта.
а) 23, 46; б) 11, 73; в) 5, 8; г) 12, 84. Вариант 21.
а) Li; б) F2; в) О2; г) H2S.
СН3ОН + 3/2 О2 → СО2 + Н2 О (ж) + 726, 64 кДж а) - 238, 7; б) - 376, 7; в) 154, 2; г) – 154, 4.
СН3ОН + 3/2 О2 → СО2 + Н2 О (ж) + 726, 64 кДж, если при увеличении температуры на 30°С константа скорости реакции возрастет в 100 раз? а) увеличится в 27 раз; б) возрастет в 100 раз; в) увеличится в 800 раз; г) не изменится.
а) 5, 33; б) 6, 75; в) 3, 67; г) 10, 67. Вариант 22.
а) KMnO4 + KJ + H2SO4; б) КМnO4 + Ва(ОН)2; в) КМnО4 + KJ + Н2О; г) MnSO4 + NaOH.
а) -2, 84 и -76, 94; б) +2, 84 и +76, 94; в) +2, 84 и – 76, 94; г) -2, 84 и + 76, 47.
Сl2 + Н2 → 2НС1, Δ Н = - 175, 7 кДж. а) увеличить давление в системе; б) снизить давление; в) увеличить температуру; г) повысить концентрацию исходных веществ.
а) 19, 95; б) 9, 9; в) 18, 88; г) 4, 95. Вариант 23.
а) Сг³ +; б) Сг² +; в) СгО4² ־; г) Сг2О7² ־.
Возможен ли этот процесс в стандартных условиях? а) - 31, 35; да; б) 31, 35; нет; в) - 31, 35; нет; г) 31, 35; да. Как изменится скорость прямой реакции Сl2 + Н2 -----> 2 НС1, Δ Н = - 175, 7 кДж, при увеличении давления в 5 раз? а) не изменится; б) увеличится в 25 раз; в) увеличится в 5 раз; г) уменьшится в 5 раз.
а) 3, 48; б) 9, 66; в) 6, 97; г) 4, 83. Вариант 24.
а) H2; б) Н2; в) SO2; г) S.
а) – 1522, 4; б) – 739, 86; в) – 148, 88; г) 148, 88.
а) 0, 5 и 0, 7; б) 0, 7 и 0, 5; в) 0, 95 и 1, 15; г) 1, 15 и 0, 95.
а) 18, 4; б) 9, 2; в) 4, 9; г) 36, 8. Вариант 25.
Р + HNO3 (конц.) а)PH3; б) Н3РО4; в) Р2О5; г) Н3РО4.
из следующих уравнений: С (алмаз) + О2 → СО2 + 395, 4 кДж: С (графит) + О2 → СО2 + 393, 5 кДж. а) – 10, 5; б) + 1, 9; в) – 1, 9; г) + 10, 5.
а) 6, 15; б) 0, 75; в) 100; г) 0, 45.
а) 0, 228; б) 0, 114; в) 0, 45б; г) 0, 057. Вариант 26.
Вг2 + КОН → KBrO3 + KBr + Н2О а) 18; б) 9; в) 15; г) 12.
С12H22O11 + H2O → 2 C6H12O6. а) – 302, 2; б) 16, 78; в) + 302, 2; г) – 16, 3.
при некоторой температуре равна 40. Вычислить начальную концентрацию хлора, если в состоянии равновесия концентрация оксида углерода (II) равна 0, 2, а фосгена 0, 8 моль/л. а) 0, 2; б) 0, 8; в) 0, 9; г) 0, 1.
а) 3, 26; б) 6, 52; в) 2, 63; г) 5, 26. Вариант 27.
Са + H2SO4 (конц.) → а) Н2; б) H2S; в) S; г) SO2.
а) 7, 19; б) 8, 36; в) 12, 3; г) 20, 14.
а) 0, 74; б) 0, 63; в) 0, 37; г) 0, 81.
а) 19, 05; б) 45; в) 96, 3; г) 38, 1. Вариант 28.
К2Сг2О7 + H2O2 + H2SO4 → Cr2 (SO4)3 + О2 + K2SO4 + Н2О укажите коэффициент перед восстановителем и расставьте коэффициенты. а) 5; б) 7; в) 3; г) 10.
а) Δ Gψ > 0; б) Δ Н ̊ < 0; в) P = const, T = const; г) Δ G° = 0.
а) 10; б) 40; в) 125; г) 25.
(ρ = 0, 90 г/мл). а) 27, 95; б) 30; в) 25, 5; г) 13, 92.
Модуль 3 «Аналитическая химия» Вариант 1. 1..Определить константу диссоциации кислоты, если в 0, 1 М растворе степень ее диссоциации 25%. а) 8, 33 × 10-3; б) 5, 2 × 10-3; в) 3, 33 × 10-1; г) 5, 2 × 10-2. 2..Какова молярность 20%-ой азотной кислоты? (ρ = 1, 115 г/мл). а) 1, 72 моль/л; б) 3, 54 моль/л; в) 2, 48 моль/л; г) 2, 04 моль/л. 3. В 0, 5 л раствора содержится 4, 1 г СН3СОONa. Вычислить рН и степень гидролиза соли. а) 9, 98; h = 6, 78 × 10-3%; б) 7, 6; h = 1, 8%; в) 10, 95; h = 7, 6 × 10-2%; г) 8, 88; h = 7, 6 × 10-3%. 4. Вычислить рН раствора, полученного смешением 50 мл 0, 1 М раствора КН2РО4 и 25 мл 0, 2М К2НРО4. а) 6, 98; б) 7, 50; в) 7, 20; г) 6, 50. Вариант 2. 1. Вычислить рН раствора, полученного смешением 70 мл 0, 2 М КН2Cit и 30 мл 0, 1М К2НCit (Cit3- - анион лимонной кислоты). а) 4, 00; б) 5, 77; в) 4, 09; г) 3, 65. 2. Определить Ка, если в 0, 01М растворе кислота диссоциирована на 30%. а) 2, 85 × 10-3; б) 1, 32 × 10-2; в) 2, 85 × 10-2; г) 1, 28 × 10-3. 3. Какова молярность серной кислоты, если к 100 мл воды добавили 20 мл Н2SО4 (ρ = 1, 835 г/мл)? а) 0, 65М; б) 1, 76М; в) 2, 56М; г) 1, 63М. 4. К 30 мл воды прибавили 5 мл 3М раствора КNO2. Вычислить рН раствора. а) 8, 46; б) 9, 53; в) 10, 80; г) 8, 63. Вариант 3. 1. Вычислить рН и степень гидролиза соли в 0, 05М Na2СО3. Чему будет равен рН, если раствор разбавить водой в 5 раз? а) 10, 67; 5, 5%; 11, 51; б) 11, 51; 6, 42%; 11, 16; в) 11, 16; 3, 34%; 10.67; г) 11, 16; 4, 42%; 9, 78. 2. Вычислить рН раствора, полученного смешением 210 мл 0, 1М Na2СО3 и 90 мл 0, М НСl. а) 10, 45; б) 9, 88; в) 11, 9; г) 9, 05. 3. Определить концентрацию раствора уксусной кислоты, если α = 2%. Ка=1, 75 × 10-5. а) 0, 032; б) 0, 022; в) 0, 044; г) 0, 014. 4. В 0, 5 л соляной кислоты содержится 0, 1 моль НСl. Определить массовую долю кислоты в растворе. а) 0, 245%; б) 0, 322%; в) 0, 567%; г) 0, 728%. Вариант 4. 1. К 250 мл 10%-ой НNO3 (ρ = 1, 054 г/мл) добавили 200 мл 50%-ой азотной кислоты (ρ = 1, 310 г/мл). Какова массовая доля кислоты в растворе? а) 28, 32%; б) 22, 45%; в) 42, 56%; г) 29, 94%. 2. К 100 мл 0, 2М НСООН прибавили 100 мл 0, 2М КОН. Вычислить рН раствора. а) 7, 38; б) 8, 98; в) 8, 37; г) 8, 65. 3. Вычислить рН раствора, полученного смешением 30 мл 0, 1М КН2РО4 и 25 мл 0, 2М КОН. а) 11, 3; б) 12, 2; в) 9, 88; г) 8, 76. 4. Определить степень диссоциации кислоты в растворе с концентрацией 10-3 моль/л. Ка = 1, 75 × 10-4. а) 0, 418; б) 13, 2%; в) 1, 32; г) 4, 18%. Вариант 5. 1. Определить рН в 0, 01 М растворе бензойной кислоты, если Ка = 6, 1 × 10-5. а) рН - 5, 3; б) рН - 6, 7; в) рН - 4, 6; г) рН - 3, 1. 2. Сколько мл 96%-ой H2SO4 (ρ = 1, 835 г/мл) нужно взять, чтобы приготовить 1 л 0, 5М раствора кислоты? а) 27, 81 мл; б) 22, 45 мл; в) 14, 87 мл; г) 16, 34 мл. 3. В 200 мл раствора содержится 0, 65 г KCN. Определить рН и степень гидролиза соли. а) 8, 88; h = 7, 6 × 10-3%; б) 10, 95; h = 1, 6%; в) 8, 46; h = 6, 8%; г) 9, 8; h = 2, 7%. Вычислить рН раствора, полученного при смешении 30 мл 0, 1М Na2СО3 и 15 мл 0, 1М NaHCO3. а) 9, 88; б) 8, 88; в) 10, 63; г) 11, 90. Вариант 6. 1.Вычислить рН раствора, полученного смешением 30 мл 0, 2М KH2PO4 и 10 мл 0, 1М HCl. а) 2, 82; б) 3, 24; в) 5, 67; г) 7, 20. 2. Определить рН в 0, 1М растворе валерьяновой кислоты, если рК = 4, 842. а) 3, 80; б) 4, 6; в) 3, 92; г) 2, 92. 3.Сколько мл 30%-ой соляной кислоты (ρ = 1, 089 г/мл) надо взять, чтобы приготовить 0, 5 л кислоты с плотностью 1, 098 г/мл? а) 234 мл; б) 332 мл; в) 318 мл; г) 255 мл. 4. В 500 мл раствора содержится 2, 52 г Na2СО3. Определить рН раствора. а) 10, 87; б) 11, 50; в) 10, 66; г) 11, 23. Вариант 7. 1. Вычислить рН и степень гидролиза соли в 0, 05Na2С2О4. Чему будет равен рН, если раствор разбавить в 10 раз? а) 10, 96; 4, 5%; 8, 97; б) 8, 48; 6, 1 × 10-3%; 7, 98; в) 8, 66; 7, 8 × 10-4%; 9, 77; г) 7, 67; 8 × 10-2; 11, 2. 2. Вычислить рН раствора, полученного смешением 50 мл 0, 15М К2НРО4 и 45 мл 0, 3М НСl. а) 2, 64; б) 3, 97; в) 2, 22; г) 4, 66. 3. Определить степень диссоциации в 0, 1 М растворе уксусной кислоты, если к ней добавили равный объём 0, 1М соляной кислоты. а) 3, 5 × 10-2; б) 0, 875 × 10-2; в) 2, 5 × 10-3; г) 1, 75 × 10-2. 4. К 100 мл 0, 5М раствора азотной кислоты добавили 100 мл 10%-го раствора этой же кислоты (ρ = 1, 054 г/мл). Какова молярность полученного раствора? а) 1, 08М; б) 1, 65М; в) 0, 55М; г) 0, 6М. Вариант 8. 1. Определить массовую долю Н3РО4, если к 1 л 0, 5М раствора добавили 50 мл 25%-го раствора кислоты (ρ = 1, 145 г/мл). а) 6, 66%; б) 5, 47%; в) 5, 86%; г) 7, 45%. 2. К 250 мл 0, 4М НСl прибавили 250 мл 0, 4М NаОН. Вычислить рН и степень гидролиза соли. а) 10, 80; 2%; б) 11, 05; 0, 9%; в) 8, 46; 1, 8%; г) 8, 95; 2, 9%. 3. Вычислить рН раствора, полученного смешением 40 мл 0, 2М КН2РО4 и 10 мл 0, 2М КОН. а) 6, 72; б) 7, 65; в) 9, 87; г) 5, 64. 4. Определить концентрацию [Н+], [Н2АsО4-], [НАsО42-] в 0, 1М растворе мышьяковой кислоты. К1 = 5, 89 × 10-3; К2 = 1, 05 × 10-7; К3 = 3, 89 × 10-13. а) [Н+] = [Н2АsО4-] = 1, 17 × 10-3; [НАsO42-] = 6 × 10-7; б) [Н+] = [Н2АsО4-] = 1, 27 × 10-3; [НАsO42-] = 5 × 10-6; в) [Н+]= [Н2АsО4-] = 0, 17 × 10-2; г) [Н+]= [Н2АsО4-] = 2, 42 × 10-2; [НАsO42-] = 1, 05 × 10-7. Вариант 9. 1.Определить [Н+], [НS-], [S2-] в 0, 1М растворе Н2S. рК1 = 6, 96; рК2=14. а) [Н+] = [НS-] = 2 × 10-5; [S2-] = 10-7; б) [Н+] = [НS-] = 1, 05 × 10-4; [S2-] = 10-14; в) [Н+] = [НS-] = 3 × 10-5; [S2-] = 10-5; г) [Н+] = [НS-] = 4 × 10-7; [S2-] = 10-21. 2. Смешали 20 мл 10%-ой серной кислоты (ρ =1, 066 г/мл) с 50 мл 20%-ой Н2SО4 (ρ = 1, 139 г/мл). Какова массовая доля кислоты в растворе? а) 15, 30%; б) 13, 54%; в) 17, 28%; г) 14, 66%. 3. Рассчитать рН раствора, полученного при сливании равных объемов 0, 1М Н2С2О4 и 0, 2М NаОН. Вычислить степень гидролиза соли. а) 6, 98; 1, 92 × 10-4%; б) 9, 52; 1 × 10-2%; в) 10, 88; 2, 17 × 10-3%; г) 7, 77; 0, 4%. 4. Рассчитать рН полученного раствора, если к 100 мл 0, 0375М СН3СООН прибавили 0, 102 г СН3СООNа. а) 5, 44; б) 5, 32; в) 3, 79; г) 4, 27. Вариант 10. 1. Вычислить рН раствора, полученного смешением 25 мл 0, 2М СН3СООН и 15мл 0, 1М СНСООNа. а) 5, 76; б) 5, 44; в) 2, 78; г) 4, 23. 2. Определить рН в 4%-ом растворе анилина. рКв =9, 4. а) 11, 88; б) 9, 12; в) 10, 12; г) 8, 57. 3. Смешали 30 мл 20%-ой НNО3 (ρ = 1, 115 г/мл) с 30 мл 30%-го раствора НNO3 (ρ = 1, 180 г/мл). Какова молярность полученного раствора? а) 4, 57 моль/л; б) 5, 04 моль/л; в) 5, 56 моль/л; г) 5, 48 моль/л. 4.Сколько г СН СООNа нужно добавить к 500 мл воды, чтобы получить раствор с рН = 8, 52? а) 0, 56 г; б) 1, 12 г; в) 0, 078 г; г) 1, 22 г.
Модуль 4 «Органическая химия»
Вариант 1
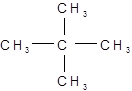
1. Органическая химия – это … а) химия соединений азота; б) химия соединений фосфора; в) химия соединений углерода. 2. Название «уксусная кислота» дано: а) согласно тривиальной номенклатуре; б) согласно рациональной номенклатуре; в) согласно международной номенклатуре IUPAC. 3. Реакция хлорирования этилена относится к следующему типу: а) замещения; б) присоединения; в) полимеризации 4. Как можно назвать данный углеводород:
а) пентан; б) 2, 2-диметилпропан; в) тетраметилметан? 5. Закончите уравнение реакции: 2СН3Cl + 2Na → …
6. Осуществите превращения: С2H6 → C2H4 → C2H5OH 7. Как можно назвать данный углеводород: СН3 – СН = СН2 а) пропен; б) пропин; в) метилэтилен? 8. Закончите уравнение реакции: 3СН º СН 9. Осуществите превращения: СН2 = СН2 → CH º CH → CH º C – СН = СН2 10. Как правильно назвать этот углеводород CH2 = CH – CH2 – CH3: а) бутен-1; б) бутен-2; в) бутин-2? 11. Какие углеводороды имеют общую формулу СnH2n-2: а) алканы; б) алкены; в) алкины; г) диены? 12. Какое соединение получится при гидратации этилена: а) этенол; б) этанол; в) этан? 13. Алкенами называются… 14. Как называются углеводороды, имеющие в молекуле одну тройную связь: а) алканы; б) алкены; в) алкины; г) диены? 15. Как называется этот радикал:
16. Как называется это соединение СН2 = СН – СН = СН2: а) дивинил; б) дифенил? в) бутадиен-1, 3 17. Напишите уравнения реакций, соответствующие следующей схеме: С3Н4 → С3Н6С12 → С3Н6 → C3H8O 18. Напишите уравнения реакций, соответствующие следующей схеме: этан → хлорэтан → X → бутадиен-1, 3 19. Напишите уравнения реакций присоединения одного или двух молей брома к одному молю бутадиена- 1, 3. 20. Напишите уравнения реакции, соответствующие следующей схеме: С2Н4 → С2Н6О → С2Н6 → С4Н8Вг2 21. Напишите уравнения реакций, соответствующие следующей схеме: бутин-1 → X → бутин-2
22. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → X → бензол
23. Напишите уравнения реакций, соответствующие следующей схеме: ацетилен → X → 2-хлорбутадиен-1, 3
Вариант 2 1. Автором теории химического строения органических соединений является: а) Жерар; б) Берцелиус; в) Бутлеров. 2. Название «этановая кислота» дано: а) согласно тривиальной номенклатуре; б) согласно рациональной номенклатуре; в) согласно международной номенклатуре IUPAC. 3. Реакция хлорирования метана относится к следующему типу: а) замещения; б) присоединения; в) полимеризации. 4. Как можно назвать данный углеводород:
б) 2-метилпропан; в) триметилметан? 5. Закончите уравнение реакции: СН2 = СН2 + HCl → …
6. Осуществите превращения: С2Н4 → C2H6 → C2H5Cl
7. Как можно назвать данный углеводород:
а) изопрен; б) бутадиол-1, 3; в) 2-метилбутадиен-1, 3? 8. Закончите уравнение реакции: СН º СН + Н2О → …
9. Осуществите превращения: СН º СН → СН2 Дата добавления: 2014-10-22; просмотров: 1956. Нарушение авторских прав; Мы поможем в написании вашей работы! Броматометрия и бромометрия Броматометрический метод основан на окислении восстановителей броматом калия в кислой среде...
Виды сухожильных швов После выделения культи сухожилия и эвакуации гематомы приступают к восстановлению целостности сухожилия...
|

 …
… а) винил; б) пропил; в) изопропил?
а) винил; б) пропил; в) изопропил?





