Адсорбция
Адсорбцией называется концентрирование вещества на поверхности раздела фаз. Физическая адсорбция – обратимый процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Вальса (рис. 9, а) или в результате образования водородных связей (рис. 9, б).

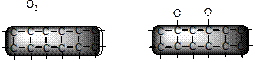
Рис. 9. Модели взаимодействия адсорбтива с адсорбционными центрами. Физическое взаимодействие: а) дисперсионное; б) образование водородных связей. Химическое взаимодействие (в) или хемосорбция
Энергия такого взаимодействия лежит в пределах 10 ¸ 100 кДж/моль и не приводит к разрыву и образованию новых химических связей. Химическая адсорбция – необратимая химическая реакция адсорбтива с адсорбентом на поверхности раздела фаз (рис. 9, в). Фактически адсорбтив и адсорбент выступают в роли реагентов экзотермической химической реакции, сопровождающейся выделением энергии в количестве 200 ¸ 400 кДж/моль. В дальнейшем мы будем рассматривать главным образом физическую адсорбцию. Поверхность, на которой происходит концентрирование вещества, называется адсорбентом. Адсорбирующееся вещество называется адсорбтивом, если оно находится в объеме и адсорбатом, если закрепилось на поверхности адсорбента.
Адсорбция на границе жидкость – газ. Уравнение адсорбции Гиббса Основы термодинамики адсорбции созданы американским физиком-теоретиком Дж. Гиббсом. Рассмотрим равновесную двухфазную систему водный раствор поверхностно-активного вещества – воздух. Поверхностно-активное вещество (ПАВ) – химическое соединение, структура которого включает неполярную углеводородную цепь, например СН3(СН2)nСН2-, соединенную с полярной группой, например такой, как -[О(СН2)2]xOH (рис. 10).
Рис. 10. Структура молекулы поверхностно-активного вещества
Молекулы воды вытесняют некоторую часть поверхностно-активного вещества на границу раздела фаз вода – воздух (газ). Полярные группы остаются в водной (полярной) среде, неполярные – в газовой фазе (неполярной среде). Так, молекулярный слой ПАВ концентрируется на границе раздела фаз. Каждая из фаз однородна, но однородность нарушается в поверхностном слое за счет избытка количества поверхностно-активного вещества (адсорбтива), который концентрируется на границе раздела фаз, внедряясь между молекулами воды. В поверхностном слое изменяется концентрация молекул воды (она уменьшается) и молекул поверхностно-активного вещества (она увеличивается) по сравнению с водным раствором ПАВ (рис. 11).
Рис. 11. Адсорбция (концентрирование) ПАВ на границе раздела фаз жидкость – газ
Внедрение неполярных углеводородных групп между молекулами воды приводит к уменьшению энергии межмолекулярного притяжения в поверхностном слое, что уменьшает поверхностное натяжение s.
Отступление. Гиббсом введена величина Г [моль/м2] (гиббсовская адсорбция), представляющая собою избыток адсорбата в объеме поверхностного слоя толщины Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента. Связь между гиббсовской адсорбцией Г, поверхностным натяжением s и концентрацией адсорбтива с в растворе устанавливается на основании термодинамических расчетов. Функция Гиббса G, отражающая состояние двухфазной системы жидкий раствор – газ, зависит от температуры Т, давления р, площади поверхности раздела фаз s, а также количества адсорбата n 1 (ПАВ) и растворителя n 2: G = f (p, T, s, n 1, n 2),
При постоянной температуре и давлении (р, Т = const) уравнение (2.7) примет вид: dG = где
dG = dG = d (s s + m 1 n 1 + m 2 n 2), где G = s s + m 1 n 1 + m 2 n 2. Полный дифференциал функции G: dG = s ds + sd s + m 1 dn 1 + n 1 dm 1 + m 1 dn 1 + n 1 dm 1. (2.10) Принимая во внимание уравнение (2.9), получим: sd s + n 1 dm 1 + n 2 dm 2 = 0. (2.11) Уравнение (2.11) отражает энергетическое состояние поверхностного слоя (sd s), а также количества адсорбата n 1 и растворителя n 2 в поверхностном слое. Объемная фаза раствора не зависит от энергетического состояния поверхностного слоя и уравнение (2.11) для объемной фазы имеет вид:
где Из уравнения (2.12) следует
Подставим значение dm 2 в уравнение (2.11), получим:
или
где Из уравнения (2.13) следует:
Для разбавленных растворов:
Подставляя
Графическая зависимость адсорбции Гиббса (Г – избыток адсорбата в поверхностном слое) и поверхностного натяжения s от концентрации адсорбтива представлена на рис. 12. Прямые измерения избытка адсорбата Г [моль/м2] в поверхностном слое – трудная задача. Обычно поступают следующим образом. Экспериментально определяют зависимость поверхностного натяжения s от концентрации адсорбтива с в водном растворе и строят изотерму в координатах s от с (рис. 12). Графически определяют величины
Рис. 12. Изотерма адсорбции Г и поверхностного натяжения s от концентрации адсорбтива при Т = 298 К
Среди способов экспериментального определения поверхностного натяжения s на границе жидкость – газ рассмотрим метод наибольшего давления образования пузырьков на приборе Ребиндера (рис. 13). Поверхностное натяжение рассчитывают по формуле:
Рис. 13. Прибор Ребиндера - вакуумная пробирка с капилляром для определения поверхностного натяжения sж-г
Наряду с поверхностно-активными веществами, уменьшающими поверхностное натяжение на границе раздела фаз, существуют поверхностно-инактивные вещества, увеличивающие поверхностное натяжение. Как правило, это электролиты, соли неорганических кислот. Ионы окружены гидратными оболочками и удерживаются в объеме. Лишь незначительные количества ионов электролита проникают в поверхностный слой. Но и этого количества достаточно для увеличения поверхностного натяжения (рис. 14) на границе раздела газ – жидкость.
Рис. 14. Адсорбция поверхностно-инактивного вещества на границе раздела фаз жидкость – газ
Адсорбция на границе твердое тело – газ. Уравнение Ленгмюра Исходя из молекулярно-кинетических представлений, американский физико-химик И. Ленгмюр предложил модель адсорбции в системе твердое тело – газ, исходя из следующих положений. Во-первых, физическая адсорбция на границе твердое тело – газ происходит не на всей поверхности, а на так называемых активных центрах – участках поверхности, активно взаимодействующих с адсорбтивом. Во-вторых, энергия адсорбции – одна и та же для молекул адсорбтива. В соответствии с этими положениями при достижении состояния динамического равновесия (рис. 15) скорость адсорбции становится равна скорости десорбции – процессу, обратному адсорбции.
Рис. 15. Схема процесса адсорбции газа на твердой поверхности: а) состояние системы до начала процесса адсорбции, концентрация газа с 0; б) состояние динамического равновесия между адсорбцией и десорбцией, концентрация газа в газовой фазе с; Dх – толщина адсорбционного слоя
Для твердого адсорбента обычно остается неизвестным поверхностное натяжение sт-г и толщина поверхностного слоя (Dх), в котором концентрируется адсорбат. Чтобы преодолеть возникшее затруднение в определении параметров адсорбционного слоя, поступают следующим образом. Измеряют концентрацию адсорбтивав u [л] газовой фазы до (с 0) и после (с) контакта газа с адсорбентом, когда наступит динамическое равновесие. Разность концентраций позволяет определить избыток адсорбата n [моль] на поверхности s [м2] адсорбента и величину адсорбции Гиббса: сs = (с – с0), n =(с – с0)× u [моль],
Обычно поверхность s твердого пористого адсорбента неизвестна. В этом случае экспериментальную величину адсорбции Гиббса рассчитывают в моль на грамм адсорбента: Г [моль/г].
Физико-химический процесс адсорбции можно представить уравнением: Ац + Ад ⇄ Ац× Ад, где Ац – активные центры на поверхности, Ад – адсорбтив в объеме газовой фазы, Ац× Ад – адсорбционные центры, занятые адсорбатом. Константа равновесия адсорбции выражается уравнением: К = [Ац× Ад]/[Ац]× [Ад], где К – константа равновесия, [Ад] = с моль/м3 – концентрация адсорбтива в объеме газовой фазы, [Ац× Ад] = a моль/м2 – концентрация активных центров, занятая адсорбатом, [Ац] =(a0 – a) моль/м2 – концентрация свободных активных центров на поверхности адсорбента, a0 моль/м2 – максимальная концентрация активных центров адсорбента, которые могут быть заполнены адсорбатом. Воспользовавшись введенными обозначениями, получим выражение константы равновесия для адсорбционного процесса на поверхности:
или
Уравнение Ленгмюра может быть представлено в ином виде. В нем концентрация активных центров, занятая адсорбатом, выражена через давление газа:
где Кр = К / RT. Анализ уравнения Ленгмюра показывает, что при низких давлениях (концентрациях) газа произведением Кр× р по сравнению с единицей можно пренебречь (Кр× р < < 1), тогда уравнение (2.17) примет вид: a = a0 × Крр. В соответствии с этим уравнением наблюдается линейное нарастание количества адсорбированного вещества при увеличении давления газа. При высоких давлениях (Кр× р > > 1) достигается практически полное заполнение активных центров адсорбента. Количество адсорбированного вещества перестает зависеть от давления. Уравнение (2.17) принимает вид: a = a0 Взаимодействие адсорбтива с активными центрами адсорбента является обратимым процессом при соблюдении следующих условий: 1) на каждом адсорбционном центре может располагаться только одна молекула адсорбата, поэтому поверхность адсорбента покрывается мономолекулярным слоем адсорбата. 2) адсорбированные молекулы не взаимодействуют друг с другом. Типичная изотерма адсорбции Ленгмюра представлена на рис. 16.
Рис. 16. Изотерма адсорбции Ленгмюра
Адсорбция на границе твердое тело – раствор. Ионообменная адсорбция Ионообменная адсорбция – обратимый процесс стехиометрического обмена ионами между ионообменной смолой и раствором электролита. Ионообменные смолы или ионообменные сорбенты представляют собой гранулы полимера, напоминающие по внешнему виду крупный светлый или темно-коричневый речной песок. На поверхности гранул расположены функциональные группы, способные обмениваться катионами (катионообменная смола) или анионами (анионообменная смола) с водным раствором, содержащим сильный электролит. Катионообменная смола, содержащая на поверхности полимерной гранулы R сульфогруппы -SO3H, при контакте с раствором электролита участвует в обмене катионами: R-SO3-H+(т) + Na+(р-р) + Cl-(р-р) ® R-SO3-Na+(т) + Н+(р-р) + Сl-(р-р). Анионообменные смолы обмениваются анионами с водным раствором электролита, например: R-NH3+OH-(т) + H+(р-р) + Cl-(р-р) ® R-NH3+Cl-(т)+ Н2O(ж). Если пропустить водный раствор хлорида натрия последовательно через колонки, заполненные катионо- и анионообменными смолами, – получим чистую воду (рис. 17).
Рис. 17. Получение чистой воды при пропускании раствора хлорида натрия через ионообменные колонки
|









 .(2.7)
.(2.7) , (2.8)
, (2.8) - поверхностное натяжение,
- поверхностное натяжение, и
и  - химические потенциалы адсорбтива и воды соответственно.
- химические потенциалы адсорбтива и воды соответственно. , (2.9)
, (2.9) , (2.12)
, (2.12) и
и  количество адсорбтива и растворителя в жидкой фазе.
количество адсорбтива и растворителя в жидкой фазе. .
.
 , (2.13)
, (2.13) - избыток адсорбата в объеме поверхностного слоя толщиной Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента.
- избыток адсорбата в объеме поверхностного слоя толщиной Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента. . (2.14)
. (2.14) и
и  .
. в уравнение (2.14), получим фундаментальное адсорбционное уравнение Гиббса:
в уравнение (2.14), получим фундаментальное адсорбционное уравнение Гиббса: . (2.15)
. (2.15) для различных значений с – концентрации ПАВ в растворе и по уравнению
для различных значений с – концентрации ПАВ в растворе и по уравнению  вычисляют значения избытка адсорбата Г на поверхности адсорбента.
вычисляют значения избытка адсорбата Г на поверхности адсорбента.
 , где s - поверхностное натяжение водного раствора адсорбтива, концентрация которого с; р – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра; s0 = 71.95× 10-3 Дж/м2 - табличное значение поверхностного натяжения воды; р 0 – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра в чистой воде.
, где s - поверхностное натяжение водного раствора адсорбтива, концентрация которого с; р – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра; s0 = 71.95× 10-3 Дж/м2 - табличное значение поверхностного натяжения воды; р 0 – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра в чистой воде.


 [моль/м2].
[моль/м2]. ,
, (адсорбционное уравнение Ленгмюра) (2.16)
(адсорбционное уравнение Ленгмюра) (2.16) , (2.17)
, (2.17)











