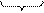Механизм образования двойного электрического слоя на границе раздела фаз
Образование двойного электрического слоя возможно в результате ориентационного, индукционного или дисперсионного взаимодействия молекул, расположенных на поверхностях соприкасающихся фаз. В этом случае поверхность одной из соприкасающихся фаз заряжается положительно, другой – отрицательно (рис. 18).
Рис. 18. Модель образования двойного электрического слоя на границе раздела фаз в результате индукционного взаимодействия: а) поверхности двух фаз до контакта; б) образование двойного электрического слоя
Положительный заряд несет поверхность, вещество которой имеет большую диэлектрическую проницаемость. Так происходит с водой, поверхность которой заряжается положительно при контакте с поверхностью менее полярных веществ (рис. 18). Другой путь возникновения двойного электрического слоя реализуется в результате избирательной адсорбции катионов или анионов на границе раздела фаз твердое тело – раствор электролита. Так происходит образование устойчивого золя (высокодисперсной коллоидной системы) йодистого серебра в результате обменной реакции: AgNO3(р-р) + KI(р-р) ® AgI(т)¯ + KNO3(р-р), Ag+(р-р)+NO3-(р-р) + K+(р-р) + I-(р-р) ® AgI(т)¯ + K+(р-р) + NO3-(р-р), Ag+(р-р) + I-(р-р) ® AgI(т)¯. На поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить её кристаллическую решетку (правило Панета-Фаянса). Если одна из солей, участвующая в обменной реакции, взята в избытке, например, избыток AgNO3 по отношению к KI – образуются микрокристаллы AgI (ядра) в окружении родственных кристаллической решетке положительно заряженных ионов серебра. Ионы серебра «достраивают» кристаллическую решетку уже в отсутствие ионов йода. Формируется мицелла (рис. 19), состоящая из ядра и двойного электрического слоя:
Мицелла
ядро двойной электрический слой где m - количество ионных пар в структуре ядра, n - количество потенциалопределяющих ионов, у - количество противоионов в диффузной части двойного электрического слоя.
   
Рис. 19. Модель мицеллы [AgI] mn Ag+|(n - у)NO3 - | у NO3 -.
Рис. 20. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток AgNO3; х – расстояние от поверхности частицы в объем жидкой фазы
Двойной электрический слой, окружающий ядро, включает ионы адсорбционного и диффузного слоя (рис. 20). По мере удаления от поверхности твердого тела на расстояние (х) в объем электролита наблюдается падение разности потенциалов между твердой и жидкой фазами. Полное падение потенциала в двойном электрическом слое называется термодинамическим потенциалом j0. Он включает скачки потенциалов адсорбционной (плотной) и диффузной частей двойного электрического слоя: j0 = jадс + jдиф. Полная компенсация заряда твердой поверхности суммарным зарядом противоионов происходит на расстоянии х, где заканчивается диффузионный слой. Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину гидратированного иона (гидратированные ионы адсорбционного слоя обведены пунктирными кружками). Ядро с адсорбционным слоем прочно связано электростатическими и адсорбционными силами и образует единое целое – заряженную микрочастицу коллоидного раствора, которая свободно перемещается в дисперсионной среде независимо от диффузного слоя. При движении частицы золя разрывается двойной электрический слой на так называемой границе скольжения. Граница скольжения лежит между адсорбционным и диффузным слоем или несколько удаляется от адсорбционного в диффузный слой. В последнем случае частица «захватывает» при своем движении некоторое количество противоионов диффузного слоя. Дзета-потенциал (z) – потенциал границы скольжения. Он определяет скорость перемещения дисперсной фазы относительного дисперсионной среды (рис. 20). При избытке в растворе ионов йода (по отношению к ионам серебра) строение мицеллы изменяется:
Мицелла
[AgI] mn I - |(n - у)K + | у K +.
ядро двойной электрический слой
Рис. 21. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток КI; х – расстояние от поверхности в объем жидкой фазы
По цвету золь йодистого серебра напоминает молоко. Частицы золя имеют размеры, соответствующие высокодисперсной системе (10-9 ¸ 10-7м). Они не оседают из-за небольшой массы и не слипаются в силу того, что имеют одинаковый знак заряда частиц золя. Обратим еще раз внимание на правило Панета-Фаянса: на поверхности частиц золя адсорбируются родственные кристаллу ионы серебра или йода, и лишь затем располагаются противоионы. Знак и величина заряда частицы зависят в существенной степени от специфической адсорбции потенциалоопределяющих ионов. Может оказаться, что адсорбционные силы и концентрация противоионов настолько высока, что происходит перезарядка частиц золя. В этом случае дзета-потенциал изменяет свой знак (рис. 22).
Рис. 22. Изменение z-потенциала поверхности при перезарядке частиц золя
Так происходит, если к золю йодистого серебра Мицелла
[AgI] mn I - |(n - у)K + | у K +.
ядро двойной электрический слой добавить, например, нитрат железа Fe(NO3)3. Ионы Fe3+ обладают высокой адсорбционной способностью. Они будут входить в адсорбционный (плотный) слой вместе с ионами К+ в таком количестве, что изменят знак заряда частицы золя. При этом ионы Fe3+ не способны достраивать кристаллическую решетку частиц золя в силу действия известного правила Панета-Фаянса, т.к. не имеют никакого сходства по размеру (неизоморфны) с ионами серебра Ag+, входящими в ионную кристаллическую решетку частиц золя: Мицелла
ядро двойной электрический слой Это приводит к перезарядке частиц золя.
|





 [AgI] mn Ag+|(n - у)NO3 - | у NO3 -.
[AgI] mn Ag+|(n - у)NO3 - | у NO3 -.






 Потенцииалоопределяющими становятся ионы йода, и микрочастицы приобретают отрицательный заряд (рис. 21).
Потенцииалоопределяющими становятся ионы йода, и микрочастицы приобретают отрицательный заряд (рис. 21).



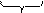

 [AgI] mn I - |(n K + + у Fe3+)| (n + 3 у NO3 -.
[AgI] mn I - |(n K + + у Fe3+)| (n + 3 у NO3 -.