Ступенчатый гидролиз. Соли, образованные слабой двух- или многоосновной кислотой, гидролизуются ступенчато:
Соли, образованные слабой двух- или многоосновной кислотой, гидролизуются ступенчато: Na2S + H2O Û NaHS + NaOH – 1-я ступень
NaHS + H2O Û H2S + NaOH – 2-я ступень
К гидр.1> К гидр.2, то есть, по первой ступени гидролиз протекает в большей степени, чем по второй. В результате гидролиза по первой ступени образуется щелочная среда, которая подавляет гидролиз по второй ступени. Так же ступенчато гидролизуются соли слабых многокислотных оснований: FeCl3 + H2O Û FeOHCl2 + HCl – 1-я ступень
FeOHCl2 + H2O Û Fe(OH)2Cl + HCl – 2-я ступень
Fe(OH)2Cl + H2O Û Fe(OH)3 + HCl – 3-я ступень
Некоторые соли, образованные катионом слабого многокислотного основания и анионом слабой многоосновной кислоты, подвергаются полному необратимому гидролизу, разлагаются водой: Al2S3 + 6H2O ® 2Al(OH)3 ¯ + 3H2S. Поэтому при сливании водных растворов сульфата алюминия и сульфида натрия в осадок выпадает гидроксид алюминия: Al2(SO4)3 + 3Na2S + 6H2O ® 2Al(OH)3 ¯ + 3H2S + 3Na 2SO4 2Al3+ + 3S2– + 6H2O ® 2Al(OH)3 ¯ + 3H2S. Так как не существует соль карбонат железа (III), реакция между хлоридом железа (III) и карбонатом натрия протекает по уравнению: 2FeCl3 + 3Na2CO3 + 3H2O ® 2Fe(OH)3 ¯ + 3CO2 + 6NaCl 2Fe3+ + 3CO32– + 3H2O ® 2Fe(OH)3 ¯ + 3CO2.
|

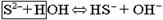
 ,
,
 .
. ,
, ,
,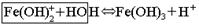 .
. . Гидролиз протекает преимущественно по первой ступени.
. Гидролиз протекает преимущественно по первой ступени.


