Контрольная работа 1
Контрольная работа № 1 содержит задачи на следующие темы: 1. Атомно-молекулярное учение.Характеристики атомов. 2. Волновые и корпускулярные свойства микрообъектов. Теория Бора, Планка, Де Бройля, Гейзенберга. 3. Основы квантовой химии. Электронные оболочки атомов. 4. Строение ядра. Ядерные превращения. 5. Количественные характеристики ядерных реакций.
При подготовке к контрольной работе рекомендуется решить все задачи из разделов для самостоятельной работы, и оценить свои знания с помощью проверочного теста.
Тест для проверки знаний: 1. Химические свойства вещества определяются тремя субатомными частицами. Две из них имеют одинаковый по величине, но противоположный по знаку заряд, а третья не имеет заряда. Эти частицы называются …………, …………… и ………………….
2. Число протонов в ядре атома указывает ……………. элемента и записывается слева в виде нижнего индекса у символа элемента. Например, для углерода число протонов у символа элемента можно записать следующим образом: …………. С.
3. Верхний слева индекс у символа элемента указывает суммарное число протонов и нейтронов в ядре атома и называется ……………….. Символ углерода, каждый атом которого содержит 6 протонов и 8 нейтронов в ядре, обозначается как ……………… С.
4. Укажите число протонов, нейтронов и электронов для атомов представленных ниже изотопов:
5. Ядро атома 8036Кг, содержит (1) 80 р и 36 n; (2) 36 р и 44
6. Какое число электронов у иона хрома 5224Сг3+: (1) 21; (2) 24; (3) 27; (4) 52?
7. Какая частица имеет большее число протонов, чем электронов: (1) Na0; (2) S0; (3) S2-; (4) Na+?
8. Массовое число изотопа равно (1) числу протонов в ядре; (2) числу нейтронов в ядре; (3) числу орбитальных электронов; (4) суммарному числу нейтронов и протонов.
9. Атом элемента имеет порядковый номер 13 и массовое число 27. Число валентных электронов у него равно (1) 2; (2) 3; (3) 4; (4) 5.
10. Октет электронов на внешней электронной оболочке имеет (1) S2+; (2) Si0; (3) О2-; (4) Na0.
11. Электронную конфигурацию благородного газа имеет (1) Те2-; (2) Ga+; (3) Fe2+; (4) Cr3+.
12. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом, равным (1) +18; (2) -18; (3) +2; (4) -2.
13. Атом какого элемента имеет электронную конфигурацию 1 s 22 s 22 p 63 s 23 p 64 s 1: (1) К; (2) Са; (3)Ва; (4) Na?
14. Электронная конфигурация иона Zn2+ соответствует формуле (1) 1 s 22 s 22 p 4 (2) 1 s 22 s 22 p 63 s 23 p 6 (3) 1 s 22 s 22 p 63 s 23 p 63 d 10 (4) 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 6
15. Три частицы: Ne0, Na+ и F- имеют одинаковое (1) массовое число; (2) число нейтронов; (3) число электронов; (4) число протонов.
16. Сколько неспаренных электронов имеет ион Со3+: (1) 3; (3) 5; (2) 4; (4) 6?
17. Распределение электронов по энергетическим уровням и подуровням у элемента с порядковым номером 79 изображается так …………………..
18. Атом какого элемента в невозбужденном состоянии имеет следующую электронную конфигурацию 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 3 (1)Р; (2) Si; (3) As; (4) Ge?
19. Ниже записаны электронные конфигурации атома серы:
Какие из этих конфигураций соответствуют основному …………, возбужденному ……….. и запрещенному (недопустимому) ………….. состояниям?
20. Электроны атома меди (порядковый номер 29) в основном состоянии распределены по орбиталям следующим образом:
(2) l s 22 s 22 p 63 s 23 p 63 d 94 s 2, (3) l s 22 s 22 p 63 s 23 p 64 s 24 d 9,
21. Ниже перечислены электронные конфигурации четырех различных атомов. В каждом случае укажите, относится ли данная конфигурация (I) к нейтральному атому или иону; (II) к основному или возбужденному состоянию:
22. Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона: (1) Са2+; (2) Сl°; (3) К°; (4) Na+?
23. Атомам каких элементов соответствуют представленные ниже электронные конфигурации?
24. Запишите конфигурации внешних электронных слоев для следующих ионов: (1) Мn4+; (2) S2-; (3) Cu+; (4) K+ ; (5) C1-; (6) Pb2+.
25. Валентные электроны атома гафния находятся на орбиталях (1) 6 s 24 f 2; (2) 6 s 25 d 2; (3) 6 s 26 p 2; (4) 6 s 25 f 2.
26. При радиоактивном излучении наибольшим проникающим эффектом обладают (1) α -частицы; (3) γ -лучи; (2) β -частицы; (4) тепловые нейтроны.
27. При радиоактивном распаде радия по схеме 22688Ra → 22286Rn + • • помимо радона образуется (1) β -частица; (3) протон; (2) стабильный изотоп свинца; (4) α -частица.
28. Гамма-излучение представляет собой поток (1) ядер гелия; (2) электронов с одинаковой энергией; (3) тепловых нейтронов; (4) квантов электромагнитного излучения.
29. Закончите схему реакции 94Ве + 42Не → 126C +. • •, выбрав один из предложенных вариантов: (1) 11 p; (3) 21Н; (2) 10 n; (4) 0-1 e.
30. В результате ядерной реакции 2713Аl + 21Н → 42Не +... образуется изотоп (1) 2512Mg; (3) 2914Si; (2) 3316S; (4) 2513Al.
31. В атоме изотопа золота 197Аu содержится • • • протонов, • •• нейтронов, • • • электронов. Ответы: 1. Электрон, протон и нейтрон. 2. Порядковый номер, 6С. 3. Массовым числом, 614С.
5. (4) 36 р и 44 n. 6. (1) 21. 7. (4) Na+. 8. (4) суммарному числу нейтронов и протонов. 9. (2) 3. 10. (3) О2-. 11. (1) Те2-. 12. (4) -2. 13.(1) К. 14. (3) 1 s 22 s 22 p 63 s 23 p 63 d 10. 15. (3) число электронов. 16. (4) 6. 17. 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 14 f 145 d 10 18. (3) As. 19. основному - (3), возбужденному – (5), запрещенному (недопустимому) – (1), (2), (4), (6). 20. (1)
22.(1) Са2+.
24. Запишите конфигурации внешних электронных слоев для следующих ионов: (1) Мn4+; 1 s 22 s 22 p 63 s 23 p 64 s 23 d 1 (2) S2-; 1 s 22 s 22 p 63 s 23 p 6 (3) Cu+; 1 s 22 s 22 p 63 s 23 p 63 d 10 (4) K+ ; 1 s 22 s 22 p 63 s 23 p 6 (5) C1-; 1 s 22 s 22 p 63 s 23 p 6 (6) Pb2+. 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 10 25. (2) 6 s 25 d 2. 26. (3) γ -лучи. 27. (4) α -частица. 28. (4) квантов электромагнитного излучения. 29. (2) 10 n. 30. (1) 2512Mg. 31. 79 протонов, 118 нейтронов, 79 электронов. Занятие №7.
|

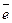 ; (3) 36 р и 80 n; (4) 36 р и 44 n.
; (3) 36 р и 80 n; (4) 36 р и 44 n.


