Сорбционные процессы
Вследствие наличия поверхностной энергии на границе раздела фаз происходит накопление тех или иных частиц. Процесс поглощения одного вещества (сорбтива) другим (сорбентом), в результате которого изменяется (как правило, повышается) концентрация первого вещества, называется сорбцией. Вещество, которое поглотилось, называется сорбатом. Процесс, обратный сорбции, называется десорбцией. В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию, капиллярную конденсацию. Адсорбция – это процесс изменения концентрации вещества на границе раздела фаз. К адсорбентам, на поверхности или в порах которого происходит адсорбция, относятся активированный уголь, силикагель, цеолиты и др. Абсорбция – это процесс поглощения вещества всем объемом сорбента. Поглощение одного вещества другим, сопровождающееся химическими реакциями, называется хемосорбцией. Капиллярная конденсация заключается в ожижении паров в микропористых сорбентах. Любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз. Адсорбция имеет место на границе раздела жидкость-газ, твердое тело-газ(жидкость), жидкость-жидкость. В результате процесса адсорбции происходит уменьшение свободной поверхностной энергии, и процесс протекает самопроизвольно. При этом чем больше поверхность адсорбента, тем больше количество адсорбата. Внутренняя поверхность адсорбентов характеризуется удельной поверхностью, т.е. поверхностью, которая приходится на 1 г сорбента. Например, активированные угли характеризуются удельной поверхностью до 1000 м2/г. Так как процесс адсорбции протекает самопроизвольно, то энергия Гиббса адсорбции имеет отрицательное значение: Δ Gадс < 0. Тепловой эффект адсорбции также имеет отрицательное значение: Δ Надс < 0. В процессе адсорбции происходит упорядочение адсорбированных частиц, следовательно, энтропия системы уменьшается: Δ Sадс < 0. Изменение энергии Гиббса системы определяется по уравнению Δ G = Δ H – TΔ S, следовательно, с увеличением температуры энергия Гиббса системы при адсорбции возрастает, и при некоторой температуре Тр энергия Гиббса системы станет равна нулю (Δ Gадс = 0, Тр·Δ Sадс = Δ Надс). В этом случае наступит равновесие, при котором скорость адсорбции равна скорости десорбции. При Т > Тр равновесие сдвигается в сторону десорбции. Следовательно, вещество можно адсорбировать при невысокой температуре и десорбировать при повышенной температуре. Количественной мерой адсорбции является поверхностный избыток вещества, равный разности его концентраций в поверхностном слое и в таком же слое внутри объема раствора – Г (гамма), иначе эта характеристика называется величиной адсорбции. Величина Г зависит от температуры и концентрации адсорбируемого вещества. Зависимость величины адсорбции от равновесной концентрации или равновесного парциального давления при постоянной температуре называется изотермой адсорбции. Наиболее часто для описания изотерм адсорбции используют уравнения Лэнгмюра и Фрейндлиха. Уравнение Лэнгмюра основывается на предположении, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой:
где Г∞ – адсорбция при максимальном заполнении; С – равновесная концентрация адсорбата; р – равновесное давление адсорбата; Ка – константа равновесия процесса адсорбции. Отношение Г/Г∞ называется степенью заполнения адсорбатом поверхности адсорбента – Θ;. Соответственно уравнение Лэнгмюра можно записать в следующем виде:
Уравнение Лэнгмюра характеризует идеализированную систему, тогда как уравнение Фрейндлиха является эмпирическим и соблюдается при адсорбции в области средних заполнений (Θ = 0, 2-0, 8): Г = КфСn или Г = Кфрn, где Кф и n – постоянные. В соответствии с изотермой адсорбции с увеличением парциального давления газа адсорбция возрастает, следовательно, при понижении давления будет происходить десорбция.
|

 или
или  ,
, или
или 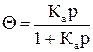 ,
,


