Последовательность элементарных актов называется механизмом реакции
Р еакция 2NO + Cl2 → 2NOCl протекает в две стадии:
а) NO + Cl2 → NOCl2 Механизм б) NOCl2 + NO→ 2NOCl реакции В ходе реакции могут образовываться промежуточные частицы и промежуточные продукты. Промежуточными частицами называются высокоактивные соединения, время жизни которых мало, и концентрация очень незначительна. В ходе процесса не происходит значительных изменений концентраций промежуточных частиц (Δ C=0). Такой подход в химической кинетике называется методом стационарных концентраций. Промежуточные продукты менее активны и могут легко быть выделены. Часто количество промежуточных продуктов сопоставимо с количеством продуктов реакции. Закон «действия масс» По закону «действия масс» скорость химической реакции пропорциональна произведению концентрации реагентов в степени их стехиометрических коэффициентов. Для реакции n A + m B → p C v = k [A]n [B]m где А и В – субстраты (исходные вещества), С – продукт реакции, n, m, р – стехиометрические коэффициенты. Коэффициенты с пмощью, которых ы уравниваем уравнение пеакции). n – порядок реакции по реагенту А, m – порядок реакции по реагенту В, n+m – суммарный порядок реакции. Таким образом, суммарный теоретический порядок реакции – это сумма коэффициентов перед субстратами в химическом уравнении. Реакция превращения ацетоуксусной кислоты в ацетон – реакция 1ого порядка: СН3-СО-СН2-СООН → СН3-СО-СН3 + СО2 v = k [A] v = k [ СН3-СО-СН2-СООН] Реакция превращения этилена в дихлорэтан имеет второй порядок: C2Н4 + Сl2 → C2H4Cl2 v = k [A][B] v = k [C2H4][Cl2] Примером реакции третьего порядка может быть реакция окисления SO2 до SO3: 2SO2 + O2 → 2SO3 v = k [A]2[B] v = k [SO2]2[O2] (2+1)=3 Если скорость реакции не зависит от концентрации реагентов, то реакция имеет нулевой порядок. Если мы имеем дело с твердым веществом, то бессмысленно говорить о его концентрации. Примером такой реакции может быть разложение твердого ВаСО3 до ВаО и СО2. На практике порядок реакции очень часто не совпадает с теоретическим: обычно реакции имеют сложный механизм и состоят из нескольких стадий (элементарных актов). Порядок реакции определяется порядком лимитирующей стадии, самой медленной стадии процесса. Часто используют порядок по какому-то одному из реагентов. Так, реакция 2NO + O2 → 2NO2 является реакцией второго порядка по NO и реакцией первого порядка по O2. Суммарный порядок равен 3. На рисунке 2 приведена зависимость скорости реакции от концентрации исходного продукта (субстрата) для реакций 1-ого, 2-ого и 3-его порядков.
[A] [A] [A] v= k [A] v = k[A]2 v= k[A]3 Рис.2. Зависимости скоростей химических реакций разного порядка от концентрации исходных веществ (субстратов) (v - скорость реакции, k - константа скорости, [A] – концентрация субстрата). В ходе реакции концентрация субстрата уменьшается, а концентрация продукта реакции возрастает. На рисунке 3 приведены зависимости концентрации субстрата и продукта реакции от времени. Эти зависимости называются кинетическими кривыми. Зависимость концентрации Зависимость концентрации субстрата от времени продукта реакции от времени C C t Рис. 3. Кинетические кривые реакций (С (t)).
|

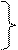



 V V V V
V V V V