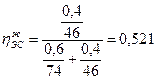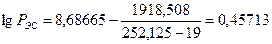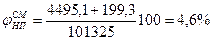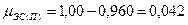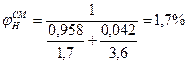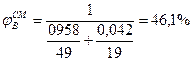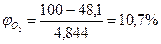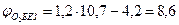Расчетные формулы
Нижний концентрационный предел распространения пламени φ н определяют по предельной теплоте сгорания. Установлено, что 1 м3 различных газовоздушных смесей на НКПР выделяет при горении постоянное среднее количество тепла - 1830 кДж, называемое предельной теплотой горения. Следовательно,
если принять среднее значение Qпр. равным 1830 кДж/м3, то φ н 6удет равно
где Qн - низшая теплота сгорания горючего вещества, кДж/м3. Нижний и верхний КПР пламени могут быть определены по аппроксимационной формуле
где n - стехиометрический коэффициент при кислороде в уравнении химической реакции; а и b эмпирические константы, значение которых приведены в табл. 2.1.1
Таблица 2.1.1.
Концентрационные пределы распространения пламени паров жидких и твердых веществ могут быть рассчитаны, если известны температурные пределы
где рн(е) - давление насыщенного пара вещества при температуре, соответствующей нижнему (верхнему) пределу распространения пламени, Па; pо -давление окружающей среды, Па. Давление насыщенного пара может быть определено по уравнению Антуана или по табл. 13 приложения
где А, В, С - константы Антуана (табл. 7 приложения); t - температура, 0С, (температурные пределы) Для расчета концентрационных пределов распространения пламени смесей горючих газов используют правило Ле-Шателье
где
Следует иметь при этом в виду, что ∑ μ i=1, т.е. концентрация горючих компонентов газовой смеси принимается за 100%. Если известны концентрационные пределы распространения пламени при температуре Т1, то при температуре Т2. они вычисляются по формулам
где Т2. и Т1; ТГ - температура горении смеси. Приближенно при определении НКПР пламени Тг принимают 1550 К, при определении ВКПР пламени -1100К. При разбавлении газовоздушной смеси инертными газами (N2, СО2 Н2О пары и т.п.) область воспламенения сужается: верхний предел снижается, а нижний - возрастает. Концентрация инертного газа (флегматизатора), при которой нижний и верхний пределы распространения пламени смыкаются, называется минимальной флегматизирующей концентрацией φ ф. Содержание кислородатакой системе называют минимальным взрывоопасным содержанием кислорода МВСК. Некоторое содержание кислорода ниже МВСК называют безопасным Расчет указанных параметров проводят по формулам
где
Пример 1. По предельной теплоте сгорания определись нижний концентрационный предел воспламенения бутана в воздухе. Решение. Для расчета по формуле (2.1.1) в табл. 15 приложения находим низшую теплоту сгорания вещества 2882, 3 кДж/моль. Эту величину надо перевести вдругую размерность - кДж/м3:
По формуле (2.1.1) определим нижний концентрационный предел распространения пламени (НКПР)
По табл. 13 приложения находим, что экспериментальное значение . Пример 2. Определить концентрационные пределы распространения пламени этилена в воздухе. Решение. Расчёт КПР пламени проводим по аппроксимационной формуле. Определяем значение стехиометрического коэффициента при кислороде С3Н4+3О2 = 2СО2+2Н2О Таким образом, n = 3, тогда
Определим относительную ошибку расчета. По табл. 13 приложения экспериментальные значения пределов составляют 3, 0-32, 0:
Следовательно, при расчете НКПР этилена результат завышен на 8%, а при расчете НКПР - занижен на 40%. Пример 3. Определим, концентрационные пределы распространения пламени насыщенных паров метанола в воздухе, если известно, что его температурные пределы составляют 280 - 312 К. Атмосферное давление нормальное. Решение. Для расчета по формуле (2.1.4) необходимо определить давление насыщенных паров, соответствующее нижнему (7°С) и верхнему (39оС) пределам распространения пламени. По уравнению Антуана (2.1.5) находим давление насыщенного пара, воспользовавшись данными табл.7 приложения.
РН=45, 7 мм.рт.ст=45, 7·133, 2=6092, 8 Па
РН=250 мм.рт.ст=250·133, 2=33300 Па По формуле (2.1.3) определим НКПР
Пример 4. Определить концентрационные пределы распространения пламени газовой смеси, состоящей 40% пропана, 50% бутана и 10% пропилена. Решение. Для расчета КПР пламени смеси газов но правилу Ле-Шателье (2.1.6) необходимо определить КПР пламени индивидуальных горючих веществ, методы расчета которых рассмотрены выше. С3Н8-2, 1÷ 9, 5%; С3Н6-2, 2÷ 10, 3%; С4Н10-1, 9÷ 9, 1%
Пример 5. Каково минимальное количество диэтилового эфира, кг, способное при испарении в ёмкости объёмом 350 м3 сосдать взрывоопасную концетрацию. Решение. Концентрация будет взрывоопасной, если φ н=φ пг где (φ пг - концентрация паров горючего вещества). Расчетом (см. примеры 1-3 данного раздела) пли по табл. 5 приложения находим НКПР пламени диэтилового эфира. Он равен 1, 7%. Определим объем паров диэтилового эфира, необходимый для создания в объеме 350 м3 этой концентрации
Таким образом, для создания НКПР диэтилового эфира о объеме 350 м3 необходимо ввести 5, 95 м3 его паров. Принимая во внимание, что 1 кмоль (74 kг) пара, приведенный к нормальным условиям, занимает объем, равный 22, 4 м1, находим количество диэтилового эфира
Пример 6. Определить, возможно ли образование взрывоопасной концентрации в объеме 50 м3 при испарении 1 кг гексана, если температура окружающей среды 300 К. Решение. Очевидно, паровоздушная смесь будет взрывоопасной, если φ н≤ φ пг≤ φ в - При 300 К объем паров гексана, образующийся в результате испарения 5 кг вещества, найдем, принимая во внимание, что при испарении 1 кмоля (86 кг) гексана при 273 К объем паровой фазы будет равен 22, 4 м3
Концентрация паров гексана впомещении объёмом 50м3, следовательно, будет равна
Определив концентрационные пределы распространения пламени гексана в воздухе (1, 2-7, 5%), по таблицам или расчетом устанавливаем, что образующаяся смесь является взрывоопасной. Пример 7. Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара, содержащего 60% диэтилового эфира (ДЭ) и 40% этилового спирта (ЭС), при температуре 245 К? Решение. Концентрация паров будет взрывоопасной, если φ смн≤ φ смнп≤ φ смв (φ смнп - концентрации насыщенных паров смеси жидкостей). Очевидно, что в результате различной летучести веществ состав газовой фазы будет отличаться от состава конденсированной фазы. Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных растворов жидкостей. 1. Определим мольный состав жидкой фазы где
2. По уравнению (2.1.5), используя значения табл.12 приложения. Находим давление насыщенного эфира и этилового спирта при температуре 19°С (245 К)
РДЭ =70, 39 мм.рт.ст=382, 6 Па
РЭС =2, 87 мм.рт.ст=382, 6 Па 3.Согласно закону Рауля, парциальное давление насыщенных паров i-й жидкости над смесью равно произведению давления насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе, т.е. РДЭ(пар )=9384, 4·0, 479=4495, 1 Па; РЭС(пар) =382, 6·0, 521=199, 3 Па. 4.Приняв сумму парциальных давлений насыщенных паров диэтилового эфира и этилового спирта равной 100%, определим а) концентрацию паров в воздухе
б) мольный состав газовой фазы (закон Рауля-Дуартье)
5. Определив расчетом или по справочным данным (табл.16 приложения) КПР пламени индивидуальных веществ (диэтиловый эфир 1, 7÷ 59%, этиловый спирт 3, 6÷ 19%). по правилу Ле-Шагелье рассчитаем КПР пламени паровой фазы
6. Сравнивая полученные в п.4, а концентрацию паровоздушной смеси с концентрационными пределами распространения пламени (1, 7-46, 1%), делаем заключение, что при 245 К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров в воздухе. Пример 8. Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом смеси паров ацетона в воздухе. Решение. По табл.15 приложения находим теплоту образования ацетона 248, 1·103 Дж/моль. Из химической формулы ацетона (С3Н6О) следует, что тс= 3, тн= 6, то= 1. Значения остальных параметров, необходимые для расчета по формуле (2.8), выбираем из табл. 11 для двуокиси углерода
Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 8, 6% смесь становится взрывобезопасной. При содержании же кислорода, равном 10, 7% эта смесь будет предельной по взрываемости. Согласно справочным данным (справочник " Пожарная опасность веществ и материалов, применяемых в химической промышленности". - М,, Химия, 1979), МВСК ацетоновоздушной смеси при разбавлении ее двуокисью углерода составляет 14, 9%. Определим относительную ошибку расчета
Таким образом, результаты расчета МВСК занижены на 28%. Задание на самостоятельную работу Задача: Рассчитать концентрационные пределы распространения пламени паров i-ro вещества в воздухе. Результаты расчета сравнить симеющимися справочными данными и определить относительную ошибку
|

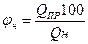 (2.1.1)
(2.1.1)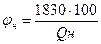 (2.1.2)
(2.1.2)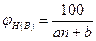 (2.1.3)
(2.1.3) (2.1.4)
(2.1.4)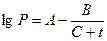 (2.1.5)
(2.1.5)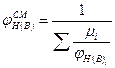 (2.1.6)
(2.1.6)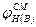 нижний (верхний) КПР пламени смеси газов, % об.;
нижний (верхний) КПР пламени смеси газов, % об.;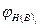 - нижний (верхний) предел распространения пламени i-ro горючего газа %, об.;
- нижний (верхний) предел распространения пламени i-ro горючего газа %, об.;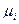 - мольная доля i-ro горючего газа в смеси.
- мольная доля i-ro горючего газа в смеси.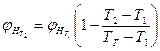 , (2.1.7)
, (2.1.7)
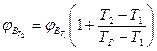 , (2.1.8)
, (2.1.8)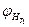 ,
, 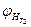 - нижний концентрационный предел распространения пламени соответственно при температурах
- нижний концентрационный предел распространения пламени соответственно при температурах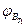 и
и 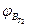 - верхний концентрационный предел распространения пламени соответственно при температурах Т1 и Т2;
- верхний концентрационный предел распространения пламени соответственно при температурах Т1 и Т2;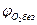 .
.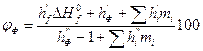 (2.1.9)
(2.1.9) (2.1.10)
(2.1.10)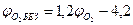 (2.1.11)
(2.1.11)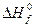 - стандартная теплота образования горючего, Дж/моль;
- стандартная теплота образования горючего, Дж/моль; ,
, 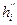 ,
,  - константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора, табл. 14 приложения;
- константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора, табл. 14 приложения;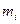 - количество атомов i-го элемента (структурной группы) в молекуле горючего.
- количество атомов i-го элемента (структурной группы) в молекуле горючего.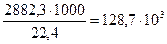 кДж/м3
кДж/м3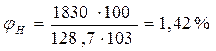
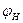 - 1, 9%. Относительная ошибка расчета, следовательно, составила
- 1, 9%. Относительная ошибка расчета, следовательно, составила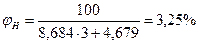
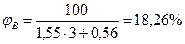
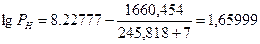
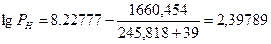
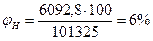
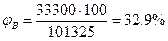

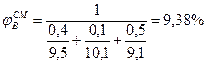
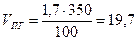 м3
м3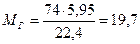 кг
кг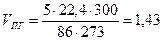 м3
м3
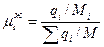 ,
, 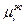 - мольная доля i-го вещества;
- мольная доля i-го вещества;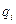 - весовая доля i-го вещества;
- весовая доля i-го вещества;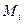 - молекулярная масса i-го вещества; (МДЭ =74, МЭС =46)
- молекулярная масса i-го вещества; (МДЭ =74, МЭС =46)