Задача 335
Определить восстановитель и окислитель, расставить коэффициенты, пользуясь методом электронно-ионных полуреакций в следующих окислительно-восстановительных реакциях: 1. Na2SO3 + КМnО4 + H2O ® Na2SO4 + МnО2 + КОH 2. NaCrO2 + H2O2 + KOH ® Na2CrO4 + K2CrO4 + H2O 3. Mn(NO3)2 + РbO2 + HN03 ® HMnO4 + РЬ(N03)2 + H2O. Решение: 1. В молекулярной схеме реакции определяем изменение степени окисления, находим окислитель и восстановитель:
в-ль о-ль среда Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
2 МnО4– + 2H2O + 3е ® МnO2 + 4OH- в-е, о-ль
Умножаем на полученные множители обе полуреакции и суммируем: 3 SO32– + 2 МnО4– + 7 H2O ® 3 SO42– + 2 МnO2 + 8 OH– + 6 Н+. После преобразования ионное уравнение реакции будет иметь следующий вид: 3 SO32– + 2 МnО4– + H2O → 3 SO42– + 2 МnO2 + 2 OH–. В молекулярной форме это уравнение запишется следующим образом: 3 Na2SO4 + 2 КМnО4 + H2O = 3 Na2SO4 + 2 МnО2 + 2 КОH.
2.
3 H2O2 + 2e ® 2 OH– в-е, о-ль
Для перехода CrO2– в ион CrO42– необходим кислород, который в щелочной среде выделяется из гидроксид-ионов (2ОН– → О2– + Н2О). Восстановление H2O2 в щелочной среде идет с образованием ионов OH–. Умножаем на полученные множители обе полуреакции и суммируем: 2CrO2– + 3H2O2 + 8OH– ® 2CrO42– + 4H2O + 6OH–. После преобразования ионное уравнение реакции следующее: 2 CrO2– + 3 H2O2 + 2 OH– → 2 CrO42– + 4 H2O. На основе ионного уравнения запишем уравнение реакции в молекулярной форме: 2 NaCrO2 + 3 H2O2 + 2 KOH ® Na2CrO4 + K2CrO4 + 4 H2O. 3.
2 Mn+2 + 4 H2O – 5е ® MnO4– + 8 Н+ o-e, в-ль 5 РbO2 + 4 Н+ + 3е ® Рb2+ + 2 H2O в-е, о-ль
После преобразования ионное уравнение реакции будет иметь вид: 2 Mn+2 + 5 РbO2 + 4 Н+ = 2 MnO4– + 5 Рb2+ + 2 H2O. 2 Mn(NO3)2 + 5 РbO2 + 6 HNO3 = 2 HMnO4 + 5 Рb(NO3)2 + 2H2O. В рассмотренных реакциях взаимодействуют вещества, одно из которых служит окислителем, а другое - восстановителем, третье - средой. Такие реакции относятся к реакциям межмолекулярного окисления-восстановления. Реакция 330(1) служит примером реакций самоокисления - самовосстановления (диспропорционирования), в которых функции окислителя и восстановителя выполняет один и тот же элемент. В реакции 330(2) оба элемента (восстановитель и окислитель) входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления. При выполнении задания рекомендуется использовать методические указания [4].
|

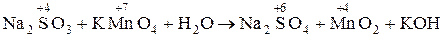
 3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль
3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль .
. 2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль .
.



