Задача 449
Исходя из величин стандартных электродных потенциалов рассчитать константу равновесия реакции, протекающей в гальваническом элементе: Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag. Решение: По ряду напряжений находим, (-) Cu½ Cu2+ ½ ½ Ag+½ Ag (+).
Между константой равновесия реакции, протекающей в гальваническом элементе, и э.д.с. элемента существует зависимость
Вычислим константу равновесия реакции:
Сопоставляя электродные потенциалы, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция. Поскольку
то окислителем будет служить ион серебра, а восстановителем – медь: рассматриваемая реакция будет протекать слева направо. По величине константы равновесия (К=3, 8 × 1015) судим о сдвиге равновесия реакции в сторону продуктов реакции. Число 1015 означает, что равновесие в данной системе наступит тогда, когда произведение концентрации ионов исходных продуктов будет в 1015 раз меньше произведения концентраций ионов конечных продуктов.
|

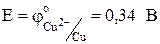 , а
, а 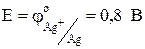 . Отсюда следует, что медный электрод будет отрицательным, т.е. анодом:
. Отсюда следует, что медный электрод будет отрицательным, т.е. анодом: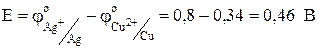
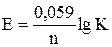 , откуда
, откуда  .
. K = 3, 8∙ 1015.
K = 3, 8∙ 1015.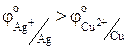 ,
,


