Задача 399
Составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента, состоящего из цинковой и никелевой пластин, опущенных в растворы сернокислых солей с концентрацией Решение: В ряду напряжений Zn стоит левее Ni, поэтому в гальваническом элементе отрицательным (анодом) будет цинковый электрод, а положительным (катодом) - никелевый. Схема гальванического элемента (-) Zn½ ZnSO4½ ½ NiSO4½ Ni (+). При работе элемента протекают реакции: на аноде Zn ® Zn2+ + 2e, на катоде Ni2+ + 2e ® Ni.
Электродные потенциалы необходимо вычислить по уравнению Нернста:
Отсюда Е = -0, 309 - (-0, 819) = 0, 51 В.
С учетом того, что число электронов, переносимых во время электрохимической реакции металлами, одинаково и концентрации растворов равны, уравнение упрощается и принимает вид
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов. Электрод, погруженный в более концентрированный раствор, положителен по отношению к другому, который погружен в более разбавленный раствор.
|

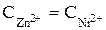 = 0, 01 моль/л.
= 0, 01 моль/л.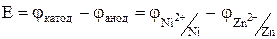
 .
. .
. .
.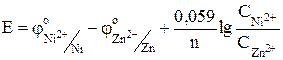 ;
;  ;
; .
.


