Электролиз. Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока
Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока. Химические реакции при электролизе обратны реакциям в гальванических элементах. При электролизе растворов солей необходимо помнить правила: 1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды: 2H2O +2e ® H2 + 2OH–. 2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода ( 3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде. 4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (S2-, I-, Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды: 2H2O + 4e ® O2 + 4H+. 5. Растворимый анод сам подвергается окислению (растворению), т.е. поcылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором: Me ↔ Men+ + ne. металл уходят уходят во анода в раствор внешнюю цепь
|

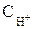 = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.


