Задача 472
Разобрать процессы, протекающие у электродов при электролизе водных растворов: Na2SO4, Cd(NO3)2, KBr, CuCl2; для каждого из них составить общее уравнение реакции. Решение: Вода может быть как окислителем, так и восстановителем, поэтому при электролизе водных растворов у электродов могут восстанавливаться и окислиться не ионы электролита, а вода. Это зависит от сравнительной величины окислительно-восстановительных потенциалов воды и ионов электролита. I. Электролиз водного раствора Na2SO4. Стандартный электродный потенциал системы
значительно отрицательнее потенциала водородного электрода в нейтральной водной среде
Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода: 2H2O +2e ® H2↑ + 2OH–, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода: 2H2O – 4e → O2 + 4H+; поскольку отвечающий этой системе стандартный электродный потенциал значительно ниже, чем стандартный электродный потенциал, характеризующий систему: 2SO42– – 2e = S2O82–, Ионы SO42–, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза: 6H2O ↔ 2H2↑ + 4OH– + O2↑ + 4H+. у катода у анода Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SO42– в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме: 2Na2SO4 + 6H2O ↔ 2H2↑ + 4NaOH + O2↑ + 2H2SO4. у катода у анода Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве). В случае, когда растворы катодного и анодного пространств перемешиваются, образующиеся в результате электролиза щелочь и кислота нейтрализуются и дают вновь соль (Na2SO4): 4NaOH + 2H2SO4 = 2NaSO4 + 4 H2O. В итоге электролиз сводится к электрохимическому разложению воды:
2. Электролиз водного раствора Cd(NO3)2. Решение: При электролизе водных растворов солей цинка, железа, кадмия и некоторых других металлов, стоящих в ряду напряжения, хотя и левее водорода, но близко к нему, на катоде выделяются эти металлы. Объясняется это тем, что процесс разрядки ионов Н+ осложняется адсорбцией атомов и молекул водорода на поверхности электродов. Для того чтобы десорбировать водород и получить его в газообразном состоянии, необходимо приложить избыточную э.д.с. Увеличение э.д.с. приводит к тому, что на катоде происходит выделение металла, стоящего в ряду напряжения левее водорода: Cd2+ + 2e ↔ Cd, Нитрат-ионы скапливаются вблизи анода, но окислению легче подвергается вода: 2H2O – 4e → O2 + 4H+, В целом процесс выражается уравнением 2Cd(NO3)2 + 2H2O ↔ 2Cd + O2↑ + 4HNO3. у катода у анода При электролезе солей, состоящих из ионов малоактивных металлов (стоящих в ряду напряжения после водорода) и кислородсодержащих анионов, также набдюдается выделение металла на катоде. На аноде выделяется кислород в результате окисления воды с изменением pH среды за счет вторичного процесса – образования кислоты. 3. Электролиз водного раствора КВr. Решение: Ионы калия обладают меньшей окислительной способностью, чем вода. Поэтому на катоде происходит восстановление воды, а на аноде – окисление брома, которые обладают большей восстановительной способностью, чем вода. катод K+, HOH; 2H2O + 2e → H2 + 2OH– в-е, о-ль PH > 7 анод Br–, HOH; 2Br– – 2e = Br2 о-е, в-ль
катионы активного металла калия, которые не восстанавливаются на катоде, накап- ливаются в прикатодном пространстве. В целом процесс выражается уравнением
4. Электролиз водного раствора СuCl2. Решение: В растворе хлорид меди (II) диссоциирует на ионы: CuCl2 «Cu2+ + 2Cl– Значение стандартного электродного потенциала меди (0, 34 В) положительно, следовательно, ионы меди(II) будут легко восстанавливаться в водных растворах: катод (-) Сu2+ + 2e ® Сu. Хлорид -анионы, как и многие анионы бескислородных кислот, окисляются в водных растворах: анод (+) 2 СI– -2e® С12 Суммарное уравнение процесса:
1 Cu2+ + 2е ® Cu в-е, о-ль;
|


 В
В
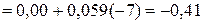 В.
В.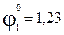 В,
В,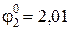 В.
В.
 В.
В. В.
В.

 1 2 Cl– – 2e ® Cl2 o-e, в-ль;
1 2 Cl– – 2e ® Cl2 o-e, в-ль;  В
В В
В



