Кислоты. С позиций теории электролитической диссоциации кислота –химическое соединение, диссоциирующее в водном растворе (или в расплаве) на положительно заряженные
С позиций теории электролитической диссоциации кислота – химическое соединение, диссоциирующее в водном растворе (или в расплаве) на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка: Все общие характерные свойства кислот – кислый уксус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями – обусловлены присутствием ионов водорода H+. По числу ионов водорода, которые образуются при диссоциации кислот, различают одноосновные, двухосновные, трехосновные кислоты. Так HCl, HNO3 – одноосновные кислоты, так как при диссоциации образуется один ион водорода; H2S, H2CO3, H2SO4 – двухосновные кислоты; H3PO4, H3AsO4 – трехосновные кислоты. Таким образом, основность кислоты определяется числом атомов водорода, которые образуются при диссоциации. Двух- и многоосновные кислоты диссоциируют ступенчато (по стадиям). Например: H3PO4 ↔ H+ + H2PO4– первая ступень; H2PO4-↔ H+ + HPO42– вторая ступень; HPO42– ↔ H+ + PO43– третья ступень. Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей мере – по второй и лишь в незначительной степени – по третьей. По наличию кислорода в своем составе кислоты делятся на кислородсодержащие (H2SO4, HNO3, H3PO4) и безкислородные (HCl, H2S). Название кислородосодержащих кислот производятся от названия элемента с прибавлением окончания – ная, - овая, если степень окисления элемента максимальная. По мере понижения степени окисления кислотообразующего элемента суффиксы меняются в следующем порядке: - оват, - ист, -оватист. Например: HClO4 - хлорная кислота, HClO3 - хлорноватистая кислота, HClO2 – хлористая кислота; HClO – хлорноватистая кислота. Названиябезкислородных кислот производятся от названия соответствующего элемента с окончанием «о» и прибавлением слова «водородная». HF –фтороводородная кислота, HCl – хлороводородная кислота. Получение кислот. Большинство кислородосодержащих кислот получают при взаимодействии кислотных оксидов с водой. Например:
Если кислотные оксиды нерастворимы в воде, то соответствующие им кислоты получают косвенным путем: действием другой кислоты (чаще всего H2SO4) на соответствующую соль. Например: Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3 ↓. Безкислородные кислоты (HF, HCl, H2S) получают путем непосредственного взаимодействия водорода с неметаллом и последующим растворением водородного соединения в воде, а также реакцией обмена между кислотой и солью. Например: H2 + S = H2S; 2NaCl + H2SO4 = Na2SO4 + 2HCl. Важнейшие химические свойства кислот следующие: 1. Взаимодействие кислот с металлами с образованием соли и выделением водорода. Например: 2HCl + Fe = FeCl2 + H2↑; H2SO3 + Ca = Ca SO3+H2↑, при этом атомы металла окисляются, а ионы водорода восстанавливаются. Металлы, стоящие в ряду стандартных электродных потенциалов правее водорода, из кислот его не вытесняют. Не выделяется водород и при взаимодействии металлов с азотной (разбавленной и концентрированной) и концентрированной серной кислотами. В этом случае восстанавливаются азот и сера:
Mg + 2HNO3 (конц) = AgNO3 + NO2 + H2O. 2. Взаимодействие кислот с основными оксидами, основаниями и солями. Например: 2НС1 + Na2O = 2Na С1 + H2O; H3PO4 + 3LiOH = Li3PO4 + 3H2O. Гидроксиды (основания) С точки зрения теории электролитической диссоциации: основаниями называются электролиты, при диссоциации которых образуются отрицательно заряженные ионы гидроксида (ОН–). Растворимые в воде основания называются щелочами. Их немного. Это основания щелочных и щелочно-земельных металлов. Большинство же оснований в воде малорастворимы. В зависимости от числа гидроксильных групп в молекуле основания различают одно-, двух-, трехкислотные основания. Например, NH4OH, KOH - однокислотные основания; Ca(OH)2, Mg(OH)2 - двухкислотные; Sc(OH)3, Al(OH)3 - трехкислотные. Таким образом, кислотность основания определяется числом гидроксильных групп в молекуле основания. Двух - и многокислотные основания диссоциируют ступенчато: Ca(OH)2 ↔ CaOH+ + OH– первая ступень; CaOH+ ↔ Ca2+ + OH– вторая ступень. Названия оснований образуются от слова " гидроксид " и названия металла. Например: LiОН -гидроксид лития, Ba(ОН)2 - гидроксид бария. Если элемент образует несколько оснований, то в названиях указывается степень его окисления (римской цифрой в скобках): Mn(ОН)2 - гидроксид марганца(II); Мп(ОН)3 - гидроксид марганца (III). Растворимые в воде основания, т.е. щелочи получают при взаимодействии металлов или их оксидов с водой: 2Rb + 2H2O = 2RbОН + H2↑; BaO + H2O = Ba(ОН)2. Нерастворимые в воде основания получают косвенным путем - действием щелочей на водные растворы соответствующих солей: MnCl2 +2CsOH = 2Mn(OH)2↓ + 2CsCl Химические свойства оснований обусловлены их отношением к кислотам, кислотным оксидам и солям: 1. При взаимодействии оснований с кислотами образуется соль и вода: KOH+HCl=KCl+H2O. 2. Щелочи (т.е. растворимые в воде основания) взаимодействуют: а) с кислотными оксидами: 2RbOH + N2O5 = 2RbNO3 + H2 O. б) с растворами солей: 2КОН + CuSO4 = Cu(OH 2 + K2 SO4↓. 3. большинство оснований при нагревании разлагается. Например: Cu(ОН)2 Соли Солями называются электролиты, при диссоциации которых образуются катионы металлов (сюда же относится и катион аммония NH4+) и анионы кислотных остатков. Например: NaCl ↔ Na++Cl-; K3PO4 ↔ 3K++PO43–. Так диссоциируют средние (или нормальные) соли. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные. Любую соль можно представить как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации. Например: 2KOH + H2SO4 = KHSO4 + 2H2O. При упаривании такого раствора выпадают кристаллы средней соли K2SO4. Если основания взято меньше, чем требуется для полной нейтрализации кислоты (например, серной в описанном выше примере), то при упаривании будут выпадать кристаллы кислой соли (KHSO4): KOH + H2SO4 = KHSO4 + H2O. В кислых солях кроме ионов металла и кислотного остатка содержатся атомы водорода. Например: NaHSO4, Na2HPO4, NaH2PO4. Диссоциацию таких солей можно выразить уравнениями: NaHSO4 ↔ Na++HSO4-NaH2PO4 ↔ Na+ + H2PO4-; Na2HPO4 ↔ 2Na++ HPO42-. Анионы кислых солей подвергаются дальнейшей диссоциации как слабые электролиты: HSO4- ↔ H+ + SO42-; H2PO4- ↔ H+ + HPO42-; HPO42-↔ H+ + PO43- Таким образом кислые соли диссоциируют по стадийно: вначале отщепляются ионы металла, а затем ионы водорода. Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Основныесоли – это соли, которые кроме ионов металла и кислотного остатка содержат гидроксогруппы. Эти соли можно представить как продукт неполного замещения гидроксогрупп основания на кислотные остатки. Например: Mg(OH)2+HCl=MgOHCl+H2O; 2Ca(OH)2+H2SO4=(CaOH)2SO4+2H2O. Диссоциацию основных солей можно выразить уравнениями: MgOHCl↔ MgOH+ + Cl-; AlOHCl2 ↔ AlOH2++ 2Cl, - Al(OH)2Cl ↔ Al(OH) 2+ + Cl-. Катионы основных солей в незначительной степени подвергаются дальнейшей диссоциации: MgOH+↔ Mg2++OH-; Al(OH)22+↔ AlOH2++OH-; AlOH2+↔ Al3++OH- Основные соли образуются многокислотными (двух- и более) основаниями. Однокислотные основания основных солей не образуют. Наиболее распространены международные названия солей. Они состоят из двух слов: названия аниона в именительном падеже и катиона в родительном. Число анионов и катионов, как правило, не указывается. Но если один и тот же металл проявляет различную степень окисления, то ее указывают в скобках римской цифрой. Например, KNO3 - нитрат калия, FeSO4 - сульфат железа (II), Fe2(SO4)3 - сульфат железа (III), NaCl - хлорид натрия. Названия кислых солей образуются добавлением к аниону приставки «гидро» -, а если необходимо, то с соответствующими числительными: NaHSO4 -гидросульфат натрия, KH2PO4 - дигидрофосфат калия. Названия основных солей образуются перечислением названий анионов, которые пишутся через дефикс: AlOHSO4 - сульфат-гидроксид алюминия, Al(OH)2Cl - хлорид-дигидроксид алюминия.
Важнейшие способы получения солей следующие: 1. Реакция нейтрализации: LiOH+HNO3 =LiNO3 +H2O; NaOH+HCl=NaCl+ H2O. 2. Взаимодействие кислот с основными оксидами: 2HCl + MgO = MgCl2 + H2O. 3. Взаимодействие кислот с солями: H2S + CuCl2 = CuS↓ + 2HCl; 4. Взаимодействие двух различных солей: Na2SO4 + BaCl2 = BaSO4↓ + 2 NaCl; 5. Взаимодействие оснований с кислотными оксидами: Ca(OH)2 +CO2 = CaCO3↓ +H2O. 6. Взаимодействие щелочей с солями: 3KOH + FeCl3 = 3KCl + Fe(OH)3. 7. Взаимодействие основных оксидов с кислотными оксидами: CaO + SiO2 = CaSiO3. 8. Взаимодействие металлов с кислотами: 2Al + 6HCl = 2AlCl3 + 3H2↑;. 9. Взаимодействие металлов с солями: Fe + CuSO4 = FeSO4 + Cu Химические свойства солей обусловлены их отношением к металлам, щелочам, кислотам и солям: 1. В ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей. Например: Zn + Hg(NO3)2 = Zn(NO3)2 + Hg; 2Al + 3PtCl2 = 2AlCl3 + 3Pt. 2. Соли взаимодействуют: а) со щелочами: MnSO4 + 2RbOH = Mn(OH)2 + Rb2SO4; б) с кислотами: CaSO4 + H2S = CaS↓ + H2SO4; в) между собой: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl; В заключение следует сказать, что между простыми веществами, оксидами, основаниями и солями существует связь, а именно - возможность их взаимного перехода. Так, например, простое вещество - металл кальций в результате соединения с кислородом превращается в оксид кальция CaО, а последний при взаимодействии с кислотой (например H2SO4) превращается в соль CaSO4. Эти превращения можно представить схемой: Са→ СаО→ Ca(OH)2→ CaSO4. Подобные превращения можно провести с неметаллами, например, серой: S → SO2 → H2SO4 → CaSO4. Итак, различными путями получена одна и та же соль. Возможен и обратный переход - от соли к другим классам неорганических соединений и простым веществам. Например, от сульфата меди путем его взаимодействия со щелочью можно перейти к гидроксиду меди (II), от него с помощью прокаливания – к оксиду меди (II), а из последнего посредством восстановления водородом при нагревания получить простое вещество – медь: CuSO4 → Cu(OH)2 → CuO → Cu. Подобная связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого класса, называется генетической. Часто получение веществ осуществляется не прямым, а косвенным путём. Например, гидроксид меди (II) нельзя получить реакцией взаимодействия оксида меди (II) с водой. В этом случае применяют косвенный путь: на оксид меди (II) действуют кислотой, получают соль, а из соли, действуя раствором щелочи, получают гидроксид меди (II). Генетическую связь между классами неорганических соединений можно выразить схемой: металл → основной оксид → основание ↓ соль ↓ неметалл → кислотный оксид → кислота
|

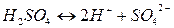 ;
; 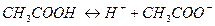 .
. ;
; 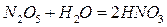 .
. ;
;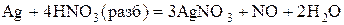 ;
;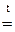 CuО + H2O; 2Fe(OH)3
CuО + H2O; 2Fe(OH)3 


