Теория рассматриваемого вопроса. Одной из важнейших теплофизических характеристик вещества является теплоемкость
Одной из важнейших теплофизических характеристик вещества является теплоемкость. Теплоемкостью называется количество теплоты, которое требуется для изменения температуры единицы количества вещества на один градус. В зависимости от количества вещества, принятого за единицу, различаются теплоёмкости: массовая – с, кДж /(кг К) – для 1 кг; мольная – c объёмная – с нормальных физических условиях. Связь между ними выражается следующими зависимостями: с c Здесь 22, 4 м условиях (T v – удельный объём газа, м
Теплоемкость одного и того же газа не является величиной постоянной и зависит от количества газа, его температуры и от характера процесса. В связи с зависимостью теплоемкости от температуры введены понятия истинная и средняя теплоемкости. Если теплоемкость определена в интервале температур от T Например, для 1 кг газа в изобарном процессе нагрева в интервале температур от T (c Истинная теплоемкость – это предел, κ которому стремится средняя теплоемкость при приближении интервала температур T с где x – параметр, определяющий характер процесса. Теплоемкость одноатомных газов не зависит от температуры и её можно считать постоянной величиной. Для двухатомных газов эта зависимость становится ощутимой только при высоких температурах (практически выше 500°С). Для трех- и многоатомных газов указанная зависимость очень существенна и может быть выражена математическим рядом: c где a приводятся в справочной литературе; t – температура газа в Величина теплоемкости различных газов зависит от атомного веса, Для идеальных газов, молекулы которых обладают только поступательными и вращательными степенями свободы, мольная теплоемкость в изохорном процессе может быть рассчитана на основе молекулярно-кинетической теории по формуле: c где R n – число степеней свободы движения (поступательного и вращательного) молекул газа. В зависимости от характера процесса в расчётах используют теплоемкости: при постоянном давлении (изобарная) – с при постоянном объеме (изохорная) – с Изобарная и изохорная теплоемкости идеального газа связаны между собой уравнением Майера: мольные – c массовые – с Поэтому, для одноатомных газов (n = 3): c c Для двухатомных газов и воздуха (n = 5) при t до 500 c c
Численные значения средних теплоемкостей различных газов в интервале температур от 0 до +1000 Например, для изобарного процесса:
Q где М – масса газа, кг; V – объём газа в кубических метрах при нормальных физических условиях. (c теплоемкости (в интервале температур от t определяемые по формулам: (c
(c Здесь (c (c
Численные значения указанных теплоемкостей в интервале температур от нуля до t Теплоёмкость веществ определяется опытным путём. Для вычисления изобарной теплоёмкости воздуха по формуле (3.3) на установке (в данной работе), называемой проточным калорифером, определяются расход воздуха, количество тепла, используемого для его нагрева, и изменение температуры.
|

 , кДж / (кмоль К) – для 1 киломоля;
, кДж / (кмоль К) – для 1 киломоля;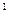 , кДж /(м
, кДж /(м 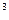 К) – для 1 м
К) – для 1 м  =
= 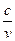 ; (3.1)
; (3.1)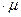 = с
= с 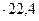 (3.2)
(3.2) = 273 K, B
= 273 K, B 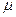 – мольная масса газа, кг / кмоль.
– мольная масса газа, кг / кмоль.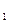 до T
до T 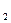 (величина нагрева газа в эксперименте конечна), то она называется средней теплоемкостью в данном интервале.
(величина нагрева газа в эксперименте конечна), то она называется средней теплоемкостью в данном интервале.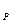 )
) 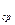 =
=  (3.3)
(3.3)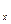 =
= 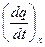 , (3.4)
, (3.4)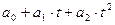 , (3.5)
, (3.5) С.
С.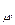 =
= 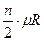 =
= 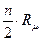 , (3.6)
, (3.6)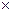 град);
град);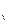 .
.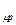 – c
– c 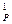 )
) 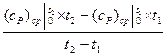 (3.10)
(3.10)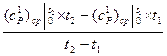 (3.11)
(3.11)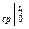 ; (c
; (c  – средние массовые изобарные теплоемкости;
– средние массовые изобарные теплоемкости; – средние объёмные изобарные теплоемкости.
– средние объёмные изобарные теплоемкости.


