Теория рассматриваемого вопроса. Адиабатным (адиабатическим) называют термодинамический процесс, протекающий без теплообмена с окружающей средой
Адиабатным (адиабатическим) называют термодинамический процесс, Для осуществления такого процесса необходимо либо идеально теплоизолировать газ, либо провести процесс расширения или сжатия газа настолько быстро, чтобы не успел произойти сколько-нибудь заметный теплообмен газа cокружающей средой. Подобные процессы происходят в двигателях внутреннего сгорания, в соплах газовых и паровых турбин, инжекторах и других устройствах. Поскольку для обратимого процесса dq = 0, то в соответствии с уравнением dq = Tds в обратимом адиабатном процессе энтропия системы сохраняется постоянной: s = const. Следовательно, обратимый адиабатный процесс является одновременно изоэнтропным (для необратимых процессов вследствие появления внутренних источников тепла Tds > dq, т.е. ds > 0). В адиабатных процессах изменяются все три основных параметра: p · v где k –показатель адиабаты (коэффициент Пуассона). Для идеального газа показатель адиабаты определяется отношением: k = где c c Мольные теплоёмкости зависят только от атомности газа. Поэтому численные значения коэффициента Пуассона для идеальных газов (см. лабо-раторную работу №3) равны: для одноатомных газов k = 20, 75 / 12, 45 = 1, 67; для двухатомных газов (и воздуха) k = 29, 35 / 20, 75 = 1, 41; для трех - и многоатомных газов k = 37, 7 / 29, 35 = 1, 29. Для реальных газов показатель адиабаты определяется экспериментальным путём.
|

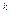 = const, (2.1)
= const, (2.1)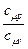 , (2.2)
, (2.2)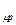 – мольная изобарная теплоёмкость газа, кДж/(кмоль К);
– мольная изобарная теплоёмкость газа, кДж/(кмоль К);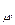 – мольная изохорная теплоёмкость газа, кДж/(кмоль К).
– мольная изохорная теплоёмкость газа, кДж/(кмоль К).


