Осмос и осмотическое давление
Закон Вант-Гоффа*
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба (рис. 4). Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа:
π V = nRT; π = nRT/V; π = СRT, где π – осмотическое давление; С – молярная концентрация раствора; R – универсальная газовая постоянная; T – абсолютная температура.
Рис. 4. Схема осмометра: 1 – вода; 2 – раствор; 3 – полупроницаемая мембрана
Осмотическое давление измеряется либо в килопаскалях (кПа), тогда R =8, 31Дж/(моль∙ К); либо в атмосферах, тогда R = 0, 082 Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называют изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже – гипотоническим. Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
2.4. Отклонение свойств разбавленных растворов солей, кислот и оснований от законов Рауля и
Изучение разбавленных растворов неэлектролитов показало, что коллигативные свойства – понижение давления пара ∆ р, изменение температур замерзания ∆ tзам и кипения ∆ tкип, осмотическое давление π изменяются пропорционально количеству растворенного неэлектролита. Экспериментально обнаружено, что для растворов электролитов осмотическое давление (π), ∆ tкип, ∆ tзам превышают значения, рассчитанные по законам Рауля и Вант-Гоффа. Шведский ученый С. Аррениус пришел к выводу, что причиной отклонения растворов электролитов от идеальных растворов является распад молекул электролита на ионы. Процесс распада молекул электролита на ионы назвали диссоциацией. Для применения законов идеальных растворов к растворам электролитов Вант-Гофф ввёл в соответствующее уравнение поправочный коэффициент i, называемый изотоническим, который показывает, во сколько раз возрастает число частиц в растворе в результате диссоциации: i = Изотонический коэффициент i для каждого раствора может быть определен экспериментально: i = где индекс э обозначает экспериментально определенные величины; индекс т − теоретические. Следовательно, для растворов электролитов формулы, выведенные ранее, принимают вид: ∆ tзам = i ККСm ∆ tкип = i КЭСm π = i Св RT Для растворов электролитов значение изотонического коэффициента i> 1; для неэлектролитов i=1.
|


 .
. .
.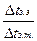 =
=  =
= 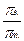 =
=  ,
,


