Закон Рауля
Опыты показывают, что давление насыщенного пара над растворами ниже, чем давление насыщенного пара над чистым растворителем (рис. 3). Французский ученый Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ∆ рА пропорционально молярной доле растворенного нелетучего вещества χ B : :
р ° А – рА = ∆ рА = р ° χ B,
где р ° А, рА – давление насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ∆ рА – разность между давлением насыщенного пара над раствором (рА) и растворителем (р ° А). Из приведенного уравнения следует, что с увеличением содержания нелетучего компонента давление пара над раствором уменьшается.
Рис.3. Зависимость давления насыщенного пара растворителя от температуры над чистым растворителем (водой) (1) и над раствором нелетучего компонента (2)
Из закона Рауля вытекают два следствия. Согласно одному из них, температура кипения раствора выше температуры кипения растворителя. Разность температур кипения раствора t 1 и чистого растворителя t 0 (∆ tкип = t 1 − t 0) называется повышением температуры кипения раствора. Повышение температуры кипения ∆ tкип пропорционально моляльной концентрации раствора: ∆ tкип = КЭСm,
где КЭ – эбуллиоскопическая постоянная растворителя, град·кг/моль; t 1 – температура кипения раствора; t 0 – температура кипения чистого растворителя; Сm – моляльная концентрация, моль/кг Сm = mв – масса вещества; Mв – молярная масса вещества, г/моль; mр-ля – масса растворителя, кг.
Согласно второму следствию из закона Рауля, температура замерзания (кристаллизации) раствора ниже температуры замерзания чистого растворителя. Разность температур замерзания чистого растворителя t 0 и начала замерзания раствора t 1 (∆ tзам = t 0 - t 1) называется понижением температуры замерзания раствора. Понижение температуры замерзания ∆ tзам пропорционально моляльной концентрации раствора: ∆ tзам = ККСm,
где Кк – криоскопическая постоянная; t 1 – температура замерзания раствора; t 0 – температура замерзания чистого растворителя.
Значения Кк и Кэ зависят от природы растворителя. Значения констант для некоторых растворителей приведены в табл. 2 приложения. Используя вышеприведенные зависимости, можно определить молярные массы растворенных веществ. Методы, основанные на исследовании зависимости ∆ tзам и ∆ tкип от концентрации растворенных веществ, называют криоскопией и эбуллиоскопией. Для определения молярной массы веществ экспериментально определяют повышение температуры кипения или замерзания растворов. Если известны массы растворенного вещества и растворителя, то молярную массу растворенного вещества МВ рассчитывают по уравнению Мв = где mв – масса растворенного вещества, г; m р-ля – масса растворителя, кг; К – криоскопическая или эбуллиоскопическая константа.
|


 ;
;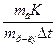 ,
,


